Модель растительной клетки своими руками из бумаги
Добрый вечер, Страна!
Сегодня у меня ПОСОБИЕ! Это волшебное слово не оставило меня равнодушной и я сама вызвалась его изобразить))
Это сравнение животной и растительной клеток в виде наглядного пособия для пятиклашек. Формат А4. Будет участвовать в конкурсе и докладах.
В зелёной оболочке — растительная клетка.
В серой оболочке с ворсинками — животная клетка.
Весь набор в разобранном виде. 17 предметов.
Некоторые детали поближе, самые любимые: митохондрии и аппарат Гольджи)
Эндоплазматическая сеть и ядро с ядрышком.
Немного объёмная вещь получилась, с петелькой для подвешивания на доске.
Вот к чему всё, собственно, велось: сравнительная характеристика. Распечатана на А4 тоже, поэтому в реале более читаемо))
Пришлось самой тщательно изучить вопрос. Если замечаете несоответствие, поправьте меня, пожалуйста!
И большое всем спасибо за внимание и комментарии)
Круто! Мы такие недавно в тетради рисовали с учебника
А почему «аппарат Гольджи»?! Вроде бы «комплекс Гольджи»?! Хотя я не знаю, может везде по-разному.
Спасибо за первый коммент! Даааа, везде по-разному пишут, мне распечатку, на которую ориентироваться, дали с «аппаратом»))) В разных источниках вообще многие запчасти по-разному называются: микроворсинки — они же реснички, центриоль — она же клеточный центр, и т.п., так что я на свой страх и риск выбирала) Сама переживаю, а вдруг не так! Вдруг криминал какой написала))
Добрый день, очень красивая работа. Ее можно приобрести и где, заранее спасибо.
Спасибо!))
Я даже не знаю чего еще ждать от твоей бурной фантазии. Строение клетки в фетр это уже чересчур))))
Здорово. Ты меня вдохновляешь на подвиги
А ты умеешь меня рассмешить))))) Пасиб)))
Я обычно не вызываюсь на подвиги, и даже долго отпираюсь, но на собрании слова «кто сделает ПОСОБИЕ?» подействовали, как гипноз, и тут я впереди всех бежала: «Я! Яяяяяааа. «)))
Модель Земли из пластилина
Пластилин – очень удобный материал для изготовления различных моделей и макетов.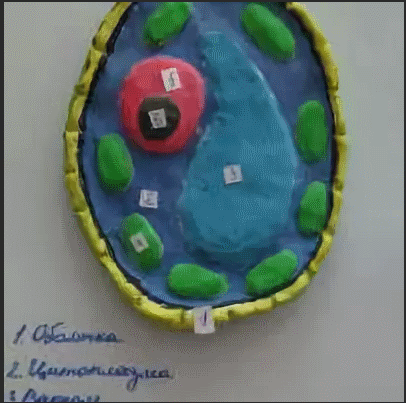 Поэтому он часто используется на уроках не только в начальной школе, но и в 5-8 классах. Пластилиновые модели молекул уже давно стали классикой жанра. Но можно сделать модели и поинтереснее.
Поэтому он часто используется на уроках не только в начальной школе, но и в 5-8 классах. Пластилиновые модели молекул уже давно стали классикой жанра. Но можно сделать модели и поинтереснее.Модель Земли из пластилина
Например, модель внутреннего строения нашей планеты. Постараемся учесть пропорции отдельных слоев Земли. Попытка соблюдения пропорций усложнит работу, но зато позволит заметить очень много деталей, которые при простом чтении учебника проходят мимо внимания ребенка.
Для работы понадобятся красный, желтый, оранжевый, коричневый, голубой, зеленый и белый пластилин. Больше всего понадобится оранжевого и желтого.
1. Отмеряем нужное количество пластилина. Самый объемный пласт Земли – мантия. Если весь объем Земли поделить на 7 равных частей, то 5 из них будет занимать мантия. Для неё возьмём целый брусок пластилина оранжевого цвета. Внутренне ядро меньше мантии по объему в 116 раз. На бруске пластилина сверху 5 полос. Отделяем одну из них и отрезаем кусочек длиной примерно 5мм (1 тетрадная клетка). Для внешнего ядра отделим полторы полоски желтого пластилина. Для литосферы — 1,5 см от одной полоски коричневого пластилина (3 тетрадных клетки). Столько же голубого пластилина для гидросферы. Совсем немного зеленого для растительного покрова и белого для полярных шапок и облаков.
Для внешнего ядра отделим полторы полоски желтого пластилина. Для литосферы — 1,5 см от одной полоски коричневого пластилина (3 тетрадных клетки). Столько же голубого пластилина для гидросферы. Совсем немного зеленого для растительного покрова и белого для полярных шапок и облаков.
2. Первая сложность в работе заключается в том, чтобы ядро оказалось в центре нашей пластилиновой планеты. Если просто закатать его в следующий слой, оно запросто может оказаться сбоку, а при разрезании модели его можно и вообще не обнаружить. Чтобы избежать этого, пластилин нужно наносить небольшими слоями. Из красного пластилина скатайте шарик. Желтый пластилин разделите на маленькие кусочки и расплющите их. Оберните красное ядро слоем желтых кусочков (получится похоже на капусту), потом покатайте шарик в ладонях, чтобы выровнять. Так, слой за слоем, нанесите все внешнее ядро из желтого пластилина.
3. Таким же способом сделайте мантию из оранжевого пластилина.
4. Вторая сложность заключается в том, что земная кора на самом деле очень тонкая. (5-70 км в нашем масштабе окажутся меньше миллиметра.) Поэтому кусочки надо будет расплющивать очень тонко. Обычно детям не хватает отмеренного пластилина, чтобы покрыть им весь шарик и приходиться добавлять вторую порцию, нарушая пропорцию модели. Зато это позволяет понять, насколько тонкая у нашей планеты внешняя твердая оболочка.
(5-70 км в нашем масштабе окажутся меньше миллиметра.) Поэтому кусочки надо будет расплющивать очень тонко. Обычно детям не хватает отмеренного пластилина, чтобы покрыть им весь шарик и приходиться добавлять вторую порцию, нарушая пропорцию модели. Зато это позволяет понять, насколько тонкая у нашей планеты внешняя твердая оболочка.
Детям постарше на этом этапе лепки можно рассказать про литосферные плиты. Каждая отдельная пластинка коричневого пластилина в нашей модели будет такой плитой, а просветы между ними – сейсмоактивными зонами, где возможны землетрясения и извержения вулканов. Лава, вытекающая из жерла вулкана, и есть вещество мантии.
5. На следующем этапе облепляем модель пластинками синего пластилина. Его точно не хватит. И не должно. У нас на планете есть несколько крупных участков суши, не покрытых водой. Это материки.
Обычно у детей получается один материк. Чем не повод рассказать о Пангее и движении материков!
Собственно на этом этапе уже можно остановиться – модель Земли из пластилина готова.
В этой работе не стоит цель придать планете географическую узнаваемость. Но если возникло такое желание, то почему нет?
Тонкими жгутиками синего пластилина выкладываем контуры материков. Потом заполняем пространство между ними.
6. Из тонких пластинок белого пластилина делаем полярные шапки.
7. Пластинки зеленого пластилина размещаем на материках подальше от экватора.
8. Из остатков белого пластилина делаем облачный покров. Совсем маленький кусочек размещаем в любом месте и размазываем круговым движением. Повторяем еще в нескольких местах.
9. Убираем модель на 15-20 минут в морозилку. Из остывшего шарика ножом вырезаем кусок, как из арбуза. Важно не слишком переморозить модель. Теплая модель будет сминаться при разрезании, а сильно замерзшая вообще не будет резаться. Если вы хотите вырезать восьмую часть, как на фотографии – сделайте это сами. Младший школьник сможет разрезать модель Земли из пластилина разве что пополам, и то не факт, что разрез пройдет через центр. Ребенок 10 -12 лет может уже вырезать четверть, что будет выглядеть эффектнее, чем две половинки.
Ребенок 10 -12 лет может уже вырезать четверть, что будет выглядеть эффектнее, чем две половинки.
Дополнительная информация
1. Внутреннее ядро нашей планеты очень горячее. Его температура 6000 градусов, это примерно столько же, сколько на поверхности Солнца. Однако из-за высокого давления, внутреннее ядро находится в твердом состоянии. Его радиус примерно 1220 км – чуть больше пятой части радиуса Земли.
2. Внешнее ядро имеет толщину примерно 2180 км. Оно жидкое, состоит в основном из железа и никеля. Именно жидкое внешнее ядро создает магнитное поле Земли.
3. Мантия находится в состоянии вязкой жидкости. Это самый большой слой нашей планеты – 2890км. Он состоит из кремния, железа и магния.
4. Земная кора – твердая оболочка Земли. Её толщина в разных местах может быть от 5 до 70 км. Но в масштабах Земли даже 70 километров – очень мало. Земная кора является частью литосферы и представляет собой верхний застывший слой мантии. Толщина литосферы в некоторых местах достигает 280км.
Толщина литосферы в некоторых местах достигает 280км.
5. Гидросфера – это вся имеющаяся на планете вода. Вода в виде жидкости может существовать только благодаря тому, что у нашей планеты есть атмосфера. А наличие атмосферы определяется массой и размером планеты и ее удаленностью от Солнца. Так, например, у Меркурия нет атмосферы – он слишком близко к Солнцу. А у далекого Плутона атмосфера есть, несмотря на то, что по размерам он меньше Меркурия. Земля находится на очень удобном расстоянии от Солнца. Но если бы у нее не было магнитного поля, её атмосферу все равно потихоньку сдуло бы солнечным ветром.
Действия учащихся | |
Ребята, мы с вами
познакомились со строением клетки кожицы лука,
рассматривая ее в микроскоп. | Работают под руководством учителя. |
Вы знаете, что любая растительная клетка покрыта снаружи толстой клеточной стенкой. Возьмите в руки пеналы из-под фотопленки – это будет наша клетка. Сожмите их в руках, почувствуйте их твердость. | Берут в руки пенал. |
Как вы думаете, почему у растительных клеток должна быть такая твердая клеточная стенка? | Отвечают на вопрос (придает форму клетке). |
Прежде чем мы будем заполнять нашу клетку органоидами, давайте нарисуем на нашей клеточной стенке клеточные поры. | Рисуют ручкой поры на
пенале. |
Для чего нужны поры в клеточной стенке? | Отвечают на вопрос (для обмена веществ с окружающей средой). |
Теперь перейдем к заполнению нашей клетки. Сначала мы поместим внутрь самый главный органоид, который управляет всеми процессами жизнедеятельности клетки. | Кладут в пенал вишню или пластилиновый шарик красного цвета. |
О каком органоиде идет речь? | Отвечают на вопрос (это ядро |
Теперь мы должны поместить внутрь органоиды, которые придают клеткам растений зеленый цвет и могут использовать для питания энергию солнца, а также те, при помощи которых осуществляется дыхание растений. | Кладут внутрь зеленые и
черные горошины. |
Что это? | Отвечают на вопрос (это хлоропласты и митохондрии). |
Очень много места в клетке занимают вакуоли – одна большая или несколько маленьких. Если представить клетку в виде маленького города-крепости, то клеточная стенка – крепостные стены, клеточные поры – крепостные ворота, ядро – дворец (штаб), хлоропласты и митохондрии – энергостанции, а вакуоль – это склад. Вы можете сделать модель старой или молодой клетки. | Из резинового шарика и ниток конструируют вакуоли и помещают их внутрь модели. |
Как по количеству и размерам вакуолей можно определить возраст клетки? | Отвечают на вопрос (молодая клетка содержит несколько мелких вакуолей, старая – одну большую, которая обычно находится в центре клетки, оттеснив ядро к периферии  |
Чтобы наша модель еще более соответствовала настоящей клетке, мы должны заполнить ее полужидким клеточным содержимым – цитоплазмой. | Заливают кисель (клейстер) внутрь пенала и закрывают его крышкой. |
Вот наша модель и готова. Вы можете подержать ее в руках, ощутить объем, наблюдать сквозь полупрозрачную оболочку движение полужидкой цитоплазмы вместе с клеточными органоидами. | Работают с моделью. |
Модель интерактивной эукариотической клетки
Органеллы растений и животных
Клетки эукариот (простейшие, растения и животные) высоко структурированы. Эти клетки, как правило, больше, чем клетки бактерий, и для них разработаны специальные механизмы упаковки и транспорта, которые могут быть необходимы для поддержания их большего размера. Используйте следующую интерактивную анимацию клеток растений и животных, чтобы узнать об их органеллах.
Подключения
Ядро
Ядрышко : Выдающаяся структура ядра — ядрышко.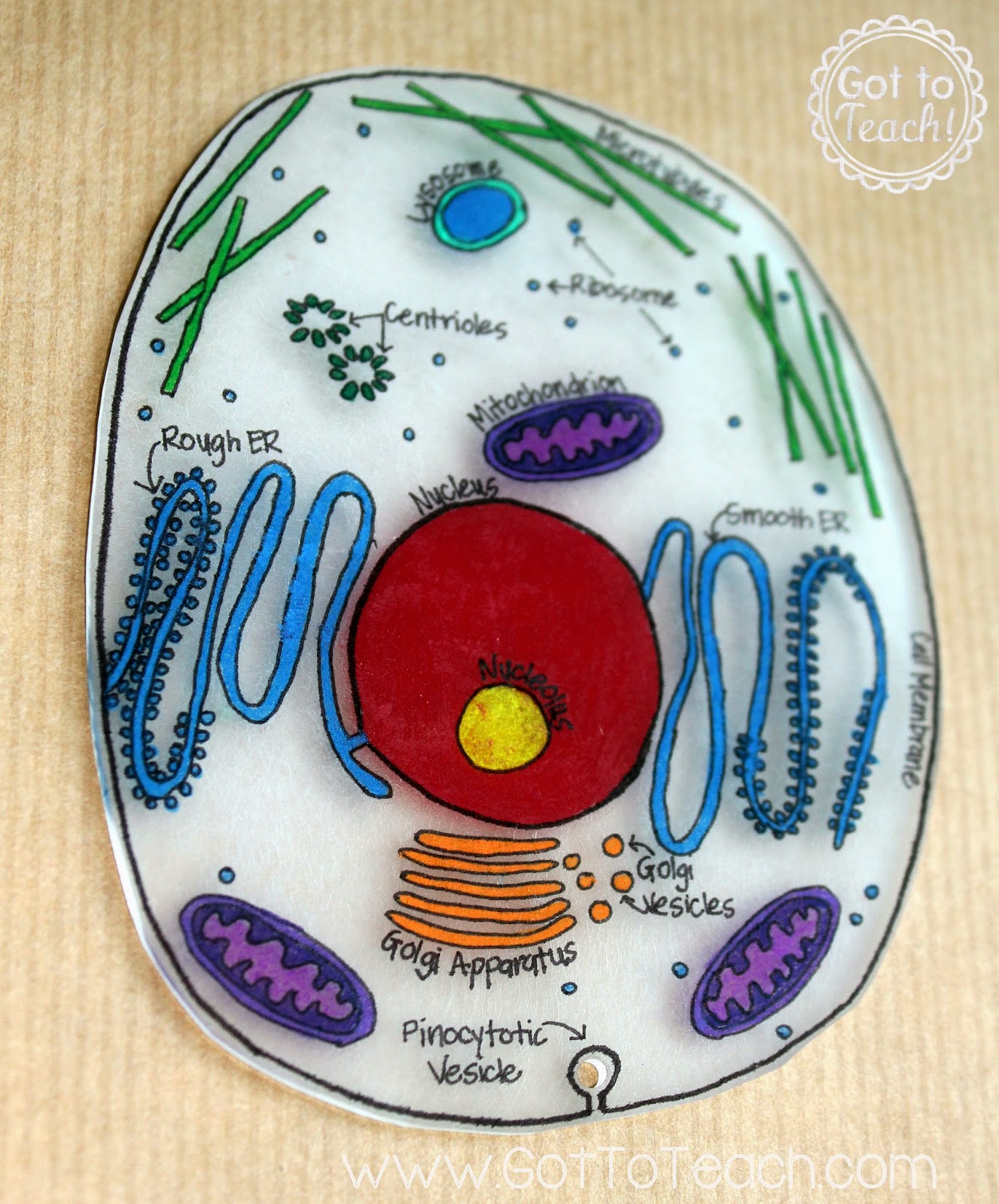 Ядрышко продуцирует рибосомы, которые выходят из ядра и занимают позиции на шероховатом эндоплазматическом ретикулуме, где они имеют решающее значение для синтеза белка.
Ядрышко продуцирует рибосомы, которые выходят из ядра и занимают позиции на шероховатом эндоплазматическом ретикулуме, где они имеют решающее значение для синтеза белка.
Цитозоль : Цитозоль — это «суп», в котором находятся все другие клеточные органеллы и где происходит большая часть клеточного метаболизма.Хотя в основном это вода, цитозоль полон белков, которые контролируют клеточный метаболизм, включая пути передачи сигналов, гликолиз, внутриклеточные рецепторы и факторы транскрипции.
Цитоплазма : это собирательный термин для цитозоля и органелл, взвешенных в цитозоле.
Центросома : Центросома, или ЦЕНТР ОРГАНИЗАЦИИ МИКРОТРУБОЧЕК (MTOC), представляет собой область в клетке, где образуются микротрубочки. Центросомы клеток растений и животных играют сходную роль в делении клеток, и обе включают коллекции микротрубочек, но центросомы растительных клеток проще и не имеют центриолей.
Во время деления клеток животных центриоли реплицируются (создают новые копии), и центросома делится.
Центриоль (только клетки животных): Каждая центриоль представляет собой кольцо из девяти групп слитых микротрубочек.В каждой группе по три микротрубочки. Микротрубочки (и центриоли) являются частью цитоскелета. В полной центросоме животных клеток две центриоли расположены так, что одна перпендикулярна другой.
Гольджи : Аппарат Гольджи представляет собой мембранно-связанную структуру с одной мембраной. На самом деле это стопка мембраносвязанных везикул, которые важны для упаковки макромолекул для транспортировки в другое место клетки. Пачка более крупных везикул окружена множеством более мелких везикул, содержащих эти упакованные макромолекулы.Ферментное или гормональное содержимое лизосом, пероксисом и секреторных везикул упаковано в мембраносвязанные везикулы на периферии аппарата Гольджи.
Лизосома : лизосомы содержат гидролитические ферменты, необходимые для внутриклеточного пищеварения. Они обычны в клетках животных, но редко в клетках растений. Гидролитические ферменты растительных клеток чаще встречаются в вакуоли.
Пероксисома : Пероксисомы представляют собой мембраносвязанные пакеты окислительных ферментов.В клетках растений пероксисомы играют множество ролей, включая преобразование жирных кислот в сахар и помощь хлоропластам в фотодыхании. В клетках животных пероксисомы защищают клетку от собственного производства токсичной перекиси водорода. Например, белые кровяные тельца производят перекись водорода для уничтожения бактерий. Окислительные ферменты в пероксисомах расщепляют перекись водорода на воду и кислород.
Секреторный пузырь : Секреции клеток — например, гормоны, нейротрансмиттеры — упакованы в секреторные пузырьки в аппарате Гольджи.Затем секреторные пузырьки переносятся на поверхность клетки для высвобождения.
Клеточная мембрана : Каждая клетка заключена в мембрану, двойной слой фосфолипидов (липидный бислой). Открытые головки бислоя являются «гидрофильными» (любящими воду), что означает, что они совместимы с водой как внутри цитозоля, так и вне клетки. Однако скрытые хвосты фосфолипидов «гидрофобны» (водобоязнь), поэтому клеточная мембрана действует как защитный барьер для неконтролируемого потока воды.Мембрана усложняется наличием множества белков, которые имеют решающее значение для клеточной активности. Эти белки включают рецепторы запахов, вкусов и гормонов, а также поры, отвечающие за контролируемый вход и выход таких ионов, как натрий (Na +), калий (K +), кальций (Ca ++) и хлорид (Cl-).
Митохондрии : Митохондрии обеспечивают клетку энергией, необходимой для движения, деления, выработки секреторных продуктов, сокращения — короче говоря, они являются энергетическими центрами клетки.Они размером с бактерии, но могут иметь разную форму в зависимости от типа клеток. Митохондрии представляют собой мембранные органеллы и, как и ядро, имеют двойную мембрану. Наружная мембрана довольно гладкая. Но внутренняя мембрана сильно извилистая, образуя складки (кристы), если смотреть в поперечном разрезе. Кристы значительно увеличивают площадь поверхности внутренней мембраны. Именно на этих кристах пища (сахар) соединяется с кислородом для производства АТФ — основного источника энергии для клетки.Центр исследования митохондрий Wellcome Trust предоставляет дополнительные ответы на вопрос «Что делают митохондрии»?
Митохондрии представляют собой мембранные органеллы и, как и ядро, имеют двойную мембрану. Наружная мембрана довольно гладкая. Но внутренняя мембрана сильно извилистая, образуя складки (кристы), если смотреть в поперечном разрезе. Кристы значительно увеличивают площадь поверхности внутренней мембраны. Именно на этих кристах пища (сахар) соединяется с кислородом для производства АТФ — основного источника энергии для клетки.Центр исследования митохондрий Wellcome Trust предоставляет дополнительные ответы на вопрос «Что делают митохондрии»?
Вакуоль : Вакуоль представляет собой мембранно-связанный мешок, который играет роль во внутриклеточном пищеварении и высвобождении продуктов жизнедеятельности клеток. В клетках животных вакуоли обычно небольшие. Вакуоли, как правило, имеют большие размеры в растительных клетках и играют несколько ролей: накапливают питательные вещества и продукты жизнедеятельности, помогают увеличивать размер клеток во время роста и даже действуют во многом как лизосомы клеток животных. Вакуоль растительной клетки также регулирует тургорное давление в клетке. Вода собирается в клеточных вакуолях, давит наружу на клеточную стенку и придает растению жесткость. Без достаточного количества воды падает тургорное давление и растение увядает.
Вакуоль растительной клетки также регулирует тургорное давление в клетке. Вода собирается в клеточных вакуолях, давит наружу на клеточную стенку и придает растению жесткость. Без достаточного количества воды падает тургорное давление и растение увядает.
Клеточная стенка (только для растительных клеток) : Растительные клетки имеют жесткую защитную клеточную стенку, состоящую из полисахаридов. В клетках высших растений этим полисахаридом обычно является целлюлоза. Клеточная стенка обеспечивает и поддерживает форму этих клеток и служит защитным барьером.Жидкость собирается в вакуоли растительной клетки и отталкивается от клеточной стенки. Это тургорное давление отвечает за хрусткость свежих овощей.
Хлоропласт (только клетки растений) : Хлоропласты — это специализированные органеллы, обнаруженные во всех клетках высших растений. Эти органеллы содержат хлорофилл растительной клетки, ответственный за зеленый цвет растения и способность поглощать энергию солнечного света. Эта энергия используется для преобразования воды и атмосферного углекислого газа в метаболизируемые сахара в ходе биохимического процесса фотосинтеза.Хлоропласты имеют двойную наружную мембрану. Внутри стромы находятся другие мембранные структуры — тилакоиды. Тилакоиды появляются в стеках, называемых «грана» (единственное число = гранум). Общественный колледж Estrella Moumtain представляет собой хороший источник информации о фотосинтезе.
Эта энергия используется для преобразования воды и атмосферного углекислого газа в метаболизируемые сахара в ходе биохимического процесса фотосинтеза.Хлоропласты имеют двойную наружную мембрану. Внутри стромы находятся другие мембранные структуры — тилакоиды. Тилакоиды появляются в стеках, называемых «грана» (единственное число = гранум). Общественный колледж Estrella Moumtain представляет собой хороший источник информации о фотосинтезе.
Гладкая эндоплазматическая сеть : По всей эукариотической клетке, особенно ответственной за выработку гормонов и других секреторных продуктов, находится обширная сеть мембраносвязанных везикул и канальцев, называемая эндоплазматической сетью, или сокращенно ЭР.ER является продолжением внешней ядерной мембраны, и его разнообразные функции предполагают сложность эукариотической клетки.
Гладкая эндоплазматическая сеть названа так потому, что при электронной микроскопии кажется гладкой. Smooth ER выполняет разные функции в зависимости от конкретного типа клеток, включая синтез липидов и стероидных гормонов, расщепление жирорастворимых токсинов в клетках печени и контроль высвобождения кальция при сокращении мышечных клеток.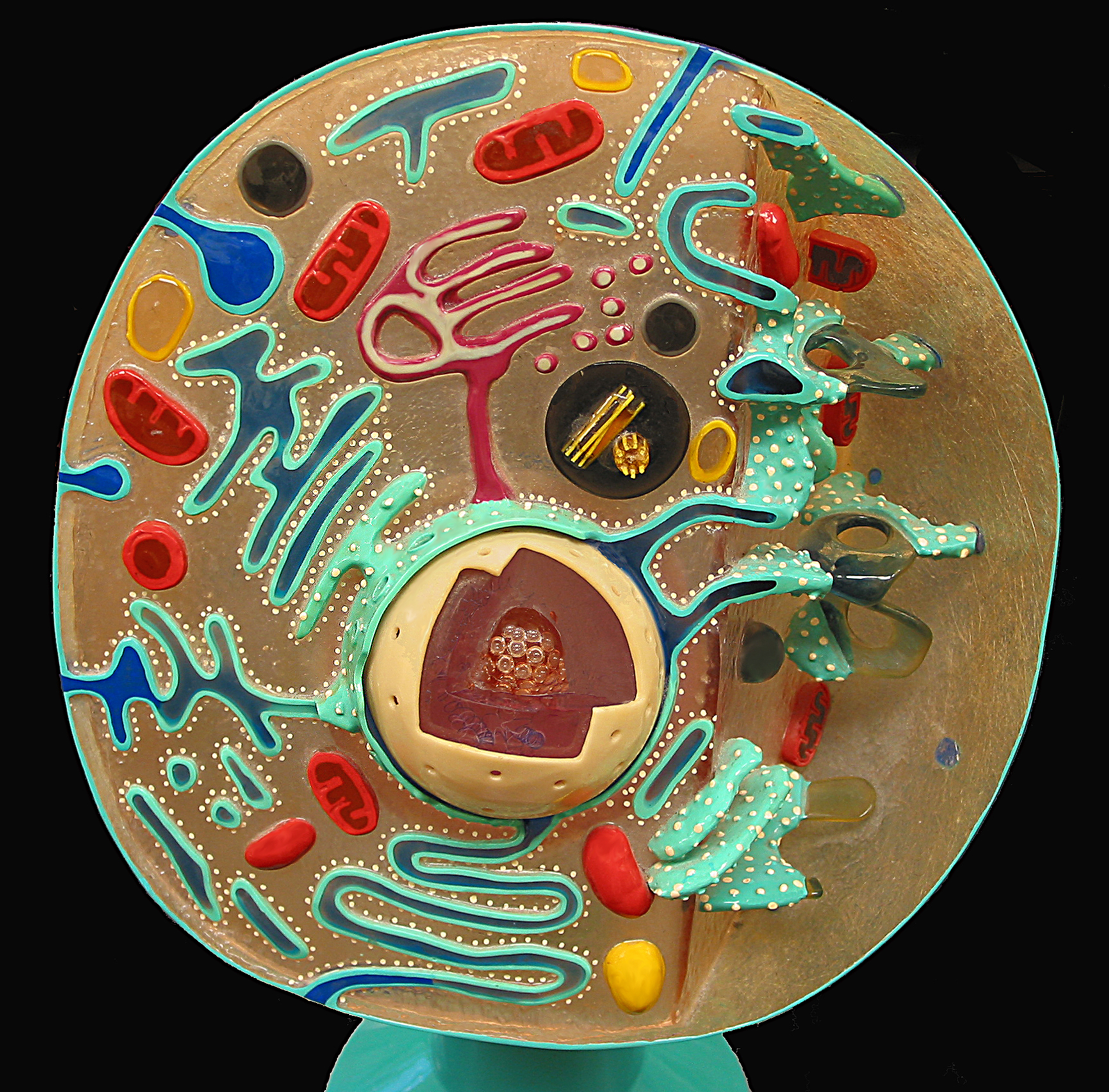
Шероховатый эндоплазматический ретикулум : Шероховатый эндоплазматический ретикулум при электронной микроскопии кажется «шершавым» из-за наличия на его поверхности множества рибосом.Белки, синтезируемые на этих рибосомах, собираются в эндоплазматическом ретикулуме для транспортировки по клетке.
Рибосомы : Рибосомы представляют собой пакеты РНК и белка, которые играют решающую роль как в прокариотических, так и в эукариотических клетках. Они являются местом синтеза белка. Каждая рибосома состоит из двух частей: большой субъединицы и малой субъединицы. Информационная РНК из ядра клетки систематически перемещается по рибосоме, где транспортная РНК добавляет отдельные молекулы аминокислот к удлиняющейся белковой цепи.
Цитоскелет : Как следует из названия, цитоскелет помогает поддерживать форму клетки. Но главное значение цитоскелета — в подвижности клеток. Внутреннее движение клеточных органелл, а также перемещение клеток и сокращение мышечных волокон не могли происходить без цитоскелета. Цитоскелет представляет собой организованную сеть из трех первичных белковых нитей:
Цитоскелет представляет собой организованную сеть из трех первичных белковых нитей:
- микротрубочек
- актиновых филаментов (микрофиламентов)
- промежуточных волокон
Лучшая цена набор инструментов для лепки пластилина — Отличные предложения на набор инструментов для лепки пластилина от global набор инструментов для лепки пластилина продавцы
Отличные новости !!! Вы попали в нужное место за набором инструментов для лепки из пластилина.К настоящему времени вы уже знаете, что что бы вы ни искали, вы обязательно найдете это на AliExpress. У нас буквально тысячи отличных продуктов во всех товарных категориях. Ищете ли вы товары высокого класса или дешевые и недорогие оптовые закупки, мы гарантируем, что он есть на AliExpress.
Вы найдете официальные магазины торговых марок наряду с небольшими независимыми продавцами со скидками, каждый из которых предлагает быструю доставку и надежные, а также удобные и безопасные способы оплаты, независимо от того, сколько вы решите потратить.
AliExpress никогда не уступит по выбору, качеству и цене. Каждый день вы будете находить новые онлайн-предложения, скидки в магазинах и возможность сэкономить еще больше, собирая купоны. Но, возможно, вам придется действовать быстро, так как этот набор инструментов для моделирования из пластилина в кратчайшие сроки станет одним из самых востребованных бестселлеров. Подумайте, как вам будут завидовать друзья, когда вы скажете им, что приобрели набор инструментов для лепки из пластилина на AliExpress.Благодаря самым низким ценам в Интернете, дешевым тарифам на доставку и возможности получения на месте вы можете еще больше сэкономить.
Если вы все еще не уверены в наборе инструментов для лепки из пластилина и думаете о выборе аналогичного товара, AliExpress — отличное место для сравнения цен и продавцов. Мы поможем вам разобраться, стоит ли доплачивать за высококачественную версию или вы получаете столь же выгодную сделку, приобретая более дешевую вещь.А если вы просто хотите побаловать себя и потратиться на самую дорогую версию, AliExpress всегда позаботится о том, чтобы вы могли получить лучшую цену за свои деньги, даже сообщая вам, когда вам будет лучше дождаться начала рекламной акции. и ожидаемая экономия.AliExpress гордится тем, что у вас всегда есть осознанный выбор при покупке в одном из сотен магазинов и продавцов на нашей платформе. Реальные покупатели оценивают качество обслуживания, цену и качество каждого магазина и продавца.Кроме того, вы можете узнать рейтинги магазина или отдельных продавцов, а также сравнить цены, доставку и скидки на один и тот же продукт, прочитав комментарии и отзывы, оставленные пользователями. Каждая покупка имеет звездный рейтинг и часто имеет комментарии, оставленные предыдущими клиентами, описывающими их опыт транзакций, поэтому вы можете покупать с уверенностью каждый раз.
Мы поможем вам разобраться, стоит ли доплачивать за высококачественную версию или вы получаете столь же выгодную сделку, приобретая более дешевую вещь.А если вы просто хотите побаловать себя и потратиться на самую дорогую версию, AliExpress всегда позаботится о том, чтобы вы могли получить лучшую цену за свои деньги, даже сообщая вам, когда вам будет лучше дождаться начала рекламной акции. и ожидаемая экономия.AliExpress гордится тем, что у вас всегда есть осознанный выбор при покупке в одном из сотен магазинов и продавцов на нашей платформе. Реальные покупатели оценивают качество обслуживания, цену и качество каждого магазина и продавца.Кроме того, вы можете узнать рейтинги магазина или отдельных продавцов, а также сравнить цены, доставку и скидки на один и тот же продукт, прочитав комментарии и отзывы, оставленные пользователями. Каждая покупка имеет звездный рейтинг и часто имеет комментарии, оставленные предыдущими клиентами, описывающими их опыт транзакций, поэтому вы можете покупать с уверенностью каждый раз. Короче говоря, вам не нужно верить нам на слово — просто слушайте миллионы наших довольных клиентов.
Короче говоря, вам не нужно верить нам на слово — просто слушайте миллионы наших довольных клиентов.
А если вы новичок на AliExpress, мы откроем вам секрет.Непосредственно перед тем, как вы нажмете «купить сейчас» в процессе транзакции, найдите время, чтобы проверить купоны — и вы сэкономите еще больше. Вы можете найти купоны магазина, купоны AliExpress или собирать купоны каждый день, играя в игры в приложении AliExpress. Вместе с бесплатной доставкой, которую предлагают большинство продавцов на нашем сайте, вы сможете приобрести набор инструментов для моделирования пластилина по самой выгодной цене в Интернете.
Мы всегда в курсе последних технологий, новейших тенденций и самых обсуждаемых лейблов.На AliExpress отличное качество, цена и сервис всегда в стандартной комплектации.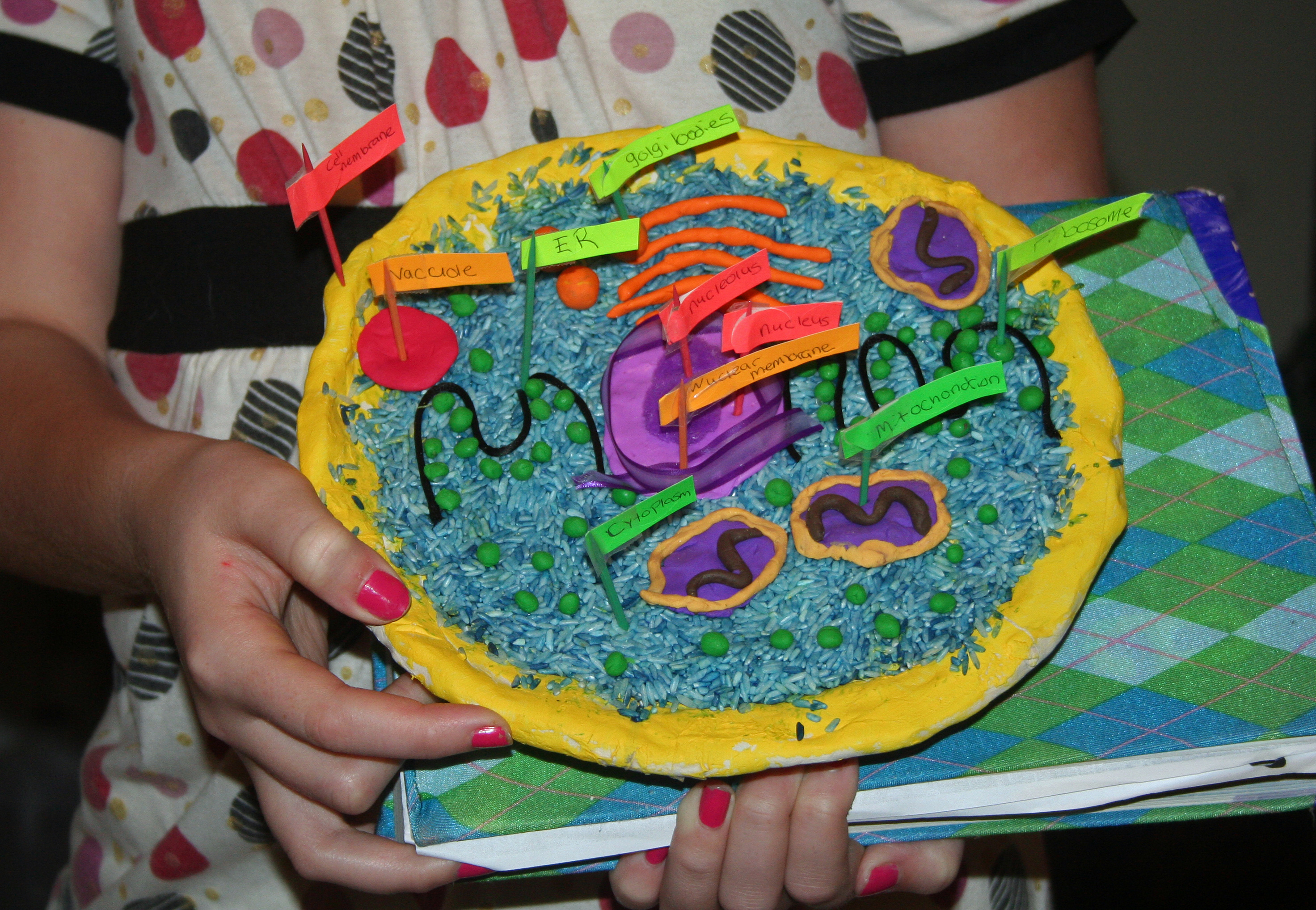 Начните самый лучший шоппинг прямо здесь.
Начните самый лучший шоппинг прямо здесь.
границ | Линия фоторецепторных клеток 661W как клеточная модель для изучения цилиопатий сетчатки
Введение
Сенсорная первичная ресничка является важной неподвижной клеточной органеллой, ответственной за обнаружение изменений во внеклеточной среде и передачу сигналов, позволяющих клетке реагировать соответствующим образом.Сетчатка содержит несколько типов реснитчатых клеток, в том числе пигментный эпителий сетчатки (РПЭ) и фоторецепторные клетки. Есть два типа фоторецепторов; палочки и колбочки, которые различаются своей формой и содержащимся в них фотопигментом. Оба типа клеток содержат внутренний сегмент, в котором расположены ядра и другие органеллы. От апикальной поверхности этого внутреннего сегмента проходит соединительная ресничка, которая содержит проксимальную область, аналогичную переходной зоне первичных ресничек на других типах клеток, и дистальную область, которая является уникальной для фоторецептора, соединяющего реснички (Dharmat et al. , 2018). В конце соединительной реснички находится огромная конструкция из стопок мембраны, в которой расположены молекулы фотопигмента; названный внешним сегментом (Sjöstrand, 1953). У стержней есть длинный, тонкий стержневидный внешний сегмент, содержащий родопсин (Wheway et al., 2014), а колбочки имеют более короткий конический внешний сегмент, содержащий опсины, которые поглощают волны различной длины, чтобы обеспечить цветовое зрение (рис. 1). Наружные сегменты конуса часто описываются как имеющие складки мембраны, продолжающиеся с плазматической мембраной, а не диски, отделенные от плазматической мембраны, но это верно только для низших позвоночных (Pearring et al., 2013; Май-Симера и др., 2017).
, 2018). В конце соединительной реснички находится огромная конструкция из стопок мембраны, в которой расположены молекулы фотопигмента; названный внешним сегментом (Sjöstrand, 1953). У стержней есть длинный, тонкий стержневидный внешний сегмент, содержащий родопсин (Wheway et al., 2014), а колбочки имеют более короткий конический внешний сегмент, содержащий опсины, которые поглощают волны различной длины, чтобы обеспечить цветовое зрение (рис. 1). Наружные сегменты конуса часто описываются как имеющие складки мембраны, продолжающиеся с плазматической мембраной, а не диски, отделенные от плазматической мембраны, но это верно только для низших позвоночных (Pearring et al., 2013; Май-Симера и др., 2017).
Рисунок 1. Схематическое изображение фоторецепторной клетки колбочки и локализация цилиарных белков. На схеме представлен внешний сегмент фоторецепторной клетки колбочки, соединяющий ресничку, внутренний сегмент, внешнее волокно, тело клетки, внутреннее волокно и синаптический конец. Ряд ключевых компонентов цилиарного аппарата обозначен и обозначен цветом. Комплекс IFT A (синий) и комплекс B (красный) представлены на увеличенной вставке.
Ряд ключевых компонентов цилиарного аппарата обозначен и обозначен цветом. Комплекс IFT A (синий) и комплекс B (красный) представлены на увеличенной вставке.
Белки перемещаются от места производства, во внутреннем сегменте, к месту поглощения света, во внешнем сегменте, вдоль соединительной реснички посредством процесса, известного как внутричерепный транспорт (IFT; Ishikawa and Marshall, 2017). Соединительная ресничка состоит из аксонемы девяти дублетов микротрубочек, образованных в основании триплетной структурой микротрубочек, называемой базальным телом. Эта структура происходит от материнской центриоли на апикальной поверхности внутреннего сегмента.Аксонема простирается во внешний сегмент, превращаясь в одиночные микротрубочки по направлению к дистальному концу, часто достигая около дистального конца внешнего сегмента конуса и по крайней мере на полпути вдоль внешнего сегмента стержня (Roof et al., 1991). Проксимальная область аксонемы стабилизируется посттрансляционными модификациями, такими как глутамилирование и ацетилирование, и переворачивается на дистальном конце по мере замещения мембран на дистальном конце внешнего сегмента, особенно в колбочках (Eckmiller, 1996).
В совокупности соединяющая ресничка и внешний сегмент называются ресничками фоторецепторов, и это наиболее сильно модифицированная и специализированная сенсорная ресничка в организме человека (Wheway et al., 2014).
Возможно, неудивительно, что дефекты ресничек часто приводят к фенотипам сетчатки, либо как часть синдромных состояний, вовлекающих другие органы, либо изолированно при так называемых цилиопатиях сетчатки (Bujakowska et al., 2017). Несиндромальные цилиопатии сетчатки включают несколько генетических подтипов пигментного ретинита (RP), врожденного амавроза Лебера (LCA) и дистрофии колбочек-стержней (CORD).
Пигментный ретинит является наиболее частой причиной наследственной слепоты, поражающей до 1: 2000 человек во всем мире (Головлева и др., 2010; Шарон и Банин, 2015), и характеризуется куриной слепотой и потерей периферического зрения из-за дегенерации палочковидные фоторецепторные клетки, часто прогрессирующие до потери центрального острого зрения, так как рецепторы колбочек также поражаются (Verbakel et al. , 2018). Обычно диагноз диагностируется на третьем или четвертом десятилетии жизни, хотя возраст начала и степень тяжести сильно различаются.Это может происходить изолированно или как часть таких синдромов, как синдром Ушера, синдром Барде-Бидля и синдром Жубера. Состояние чрезвычайно генетически неоднородно, с 64 генами, идентифицированными как причины несиндромального RP, и более 50 генов, связанных с синдромальным RP (RetNet), и могут наследоваться по аутосомно-доминантному, аутосомно-рецессивному или X-сцепленному типу.
, 2018). Обычно диагноз диагностируется на третьем или четвертом десятилетии жизни, хотя возраст начала и степень тяжести сильно различаются.Это может происходить изолированно или как часть таких синдромов, как синдром Ушера, синдром Барде-Бидля и синдром Жубера. Состояние чрезвычайно генетически неоднородно, с 64 генами, идентифицированными как причины несиндромального RP, и более 50 генов, связанных с синдромальным RP (RetNet), и могут наследоваться по аутосомно-доминантному, аутосомно-рецессивному или X-сцепленному типу.
Из генетических причин Х-сцепленных несиндромальных RP, OFD1, RP2 и RPGR кодируют белки ресничек. Внутри аутосомно-доминантного несиндромального RP (ADRP), RP1 и TOPORS (RP31) кодируют известные белки ресничек.По крайней мере 13 генетических причин аутосомно-рецессивного несиндромального RP (ARRP) кодируют белки ресничек, включая FAM161A (RP28), TTC8 (RP51), C2orf71 (RP54), ARL6 (RP55), MAK (RP62), NEK2 (RP67), BBS2 (RP74), IFT140 (RP80), ARL2BP, RP1L1, C8orf37, CC2D2A и IFT172.
Врожденный амавроз Лебера — наиболее частая генетическая причина детской слепоты, с оценкой заболеваемости во всем мире от 1:33 000 (Alstrom, 1957) до 1:81 000 живорождений (Stone, 2007). На его долю приходится 20% заболеваний глаз у детей, посещающих школы для слепых (Schappert-kimmijser et al., 1959). Пациенты с LCA рождаются с тяжелым нарушением зрения, которое обычно диагностируется в течение нескольких месяцев после рождения по сильно уменьшенным или не регистрируемым результатам электроретинограммы. Наряду с плохим зрением наблюдается нистагм (непроизвольное движение глаз) и медленная реакция зрачков или ее отсутствие. Несмотря на то, что они родились с уже плохим зрением, некоторые пациенты с LCA претерпевают дальнейшее ухудшение зрения во взрослой жизни, при этом пигментные изменения сетчатки часто происходят в более позднем возрасте (Heher et al., 1992). Это может происходить изолированно или как часть таких синдромов, как синдром Сеньора-Локена.LCA также генетически гетерогенна, с 13 известными генами, связанными с аутосомно-рецессивным LCA, и одним геном, связанным с аутосомно-доминантным LCA (RetNet см. Сноску 1).
Сноску 1).
Пять генетических подтипов LCA являются известными цилиопатиями сетчатки. LCA5 кодирует леберсилин, цилиарный транспортный белок (den Hollander et al., 2007), LCA6 кодирует RPGRIP1, белок переходной зоны ресничек (Dryja et al., 2001), LCA10 кодирует CEP290, белок переходной зоны который также мутирует при многочисленных синдромальных цилиопатиях (den Hollander et al., 2006) и LCA15 кодирует IQCB1 / NPHP5, который взаимодействует с CEP290, локализуется в переходной зоне и необходим для формирования внешнего сегмента (Estrada-Cuzcano et al., 2010; Ronquillo et al., 2016). Все эти белки локализуются в соединительной ресничке фоторецепторных клеток. CLUAP1 (IFT38) также является причиной LCA (Soens et al., 2016) и играет центральную роль в цилиогенезе фоторецепторов (Lee et al., 2014).
Дистрофии конического стержня (CRD) — это редкие дегенеративные состояния с оценочной частотой 1: 40 000 (Hamel et al., 2000). Состояние характеризуется потерей фоторецепторов колбочек, что приводит к потере центрального зрения с высокой остротой, нарушению цветового зрения (дисхроматопсия) и светобоязни, иногда с последующей дегенерацией палочковых фоторецепторов, вызывающей куриную слепоту и туннельное зрение. Обычно это диагностируется в первое десятилетие жизни (Hamel, 2007). Это может происходить как изолированное состояние или как часть синдромальной цилиопатии синдрома Альстрёма (Hearn et al., 2002; Collin et al., 2012). CRD также генетически гетерогенны: 16 аутосомно-рецессивных и пять аутосомно-доминантных генов были идентифицированы как вызывающие CRD (см. Сноску 1).Из них по крайней мере семь кодируют белки ресничек (RAB28 (CORD18), C8orf37 (CORD16), CEP78, POC1B, IFT81, RPGRIP1 и TTLL5).
Обычно это диагностируется в первое десятилетие жизни (Hamel, 2007). Это может происходить как изолированное состояние или как часть синдромальной цилиопатии синдрома Альстрёма (Hearn et al., 2002; Collin et al., 2012). CRD также генетически гетерогенны: 16 аутосомно-рецессивных и пять аутосомно-доминантных генов были идентифицированы как вызывающие CRD (см. Сноску 1).Из них по крайней мере семь кодируют белки ресничек (RAB28 (CORD18), C8orf37 (CORD16), CEP78, POC1B, IFT81, RPGRIP1 и TTLL5).
В целом, по крайней мере 30 генов ресничек были идентифицированы как генетические причины несиндромальных дистрофий сетчатки, и это число продолжает расти. Новые цилиарные причины дистрофий сетчатки продолжают обнаруживаться, и устанавливаются новые связи между ресничками и состояниями сетчатки, которые ранее не считались цилиопатиями сетчатки. Например, недавний скрининг нокдауна полногеномной siRNA в линии реснитчатых клеток идентифицировал PRPF6, PRPF8 и PRPF31, известные причины RP, как белки ресничек (Wheway et al. , 2015), предлагая новые взгляды на плохо изученную форму РП.
, 2015), предлагая новые взгляды на плохо изученную форму РП.
Ясно, что реснички имеют центральное значение для развития и функции сетчатки, с дефектами большого количества белков ресничек, ведущих к различным наследственным дистрофиям сетчатки. Дистрофии сетчатки по-прежнему чрезвычайно трудно поддаются лечению, и для подавляющего большинства пациентов существует очень мало вариантов лечения, за исключением генной терапии RPE65, CEP290 и GUY2D при LCA (DiCarlo et al., 2018). Чтобы эта ситуация улучшилась, необходимо лучшее понимание клеточной биологии и молекулярной генетики дистрофий сетчатки, включая цилиопатии сетчатки.
Это требует надежных, легко поддающихся генетической манипуляции клеточных моделей клеток сетчатки. ARPE19 (ATCC CRL-2302; Dunn et al., 1996), спонтанно возникающая линия клеток мужского пигментного эпителия сетчатки, и hTERT RPE-1 (ATCC CRL-4000), иммортализованная линия клеток женского пигментного эпителия сетчатки hTERT, обычно используются в молекулярных исследованиях. биологические исследования цилиопатий сетчатки из-за их ретинального происхождения и способности образовывать реснички при голодании сыворотки и во время позднего G1 (Spalluto et al., 2013). Однако эти клетки морфологически и функционально отличаются от фоторецепторов, и выделенная линия фоторецепторных клеток будет иметь огромное значение в этой области.Индуцированные плюрипотентные стволовые клетки (iPSCs) могут быть надежно дифференцированы в фоторецепторные клетки сетчатки после 60-дневного протокола дифференцировки (Mellough et al., 2012). Однако быстрая потеря клеток, связанных с судьбой фоторецептора (CRX + / OPSIN + / RHODOPSIN + ), наблюдается в течение 45-60 дней. То же самое явление наблюдается в клетках-предшественниках сетчатки мышей (Mansergh et al., 2010).
биологические исследования цилиопатий сетчатки из-за их ретинального происхождения и способности образовывать реснички при голодании сыворотки и во время позднего G1 (Spalluto et al., 2013). Однако эти клетки морфологически и функционально отличаются от фоторецепторов, и выделенная линия фоторецепторных клеток будет иметь огромное значение в этой области.Индуцированные плюрипотентные стволовые клетки (iPSCs) могут быть надежно дифференцированы в фоторецепторные клетки сетчатки после 60-дневного протокола дифференцировки (Mellough et al., 2012). Однако быстрая потеря клеток, связанных с судьбой фоторецептора (CRX + / OPSIN + / RHODOPSIN + ), наблюдается в течение 45-60 дней. То же самое явление наблюдается в клетках-предшественниках сетчатки мышей (Mansergh et al., 2010).
В качестве альтернативы этому оптические чашки, полученные из эмбриональных стволовых клеток мыши (Eiraku et al., 2011), эмбриональные стволовые клетки человека (Nakano et al. , 2012) и ИПСК человека (Meyer et al., 2011; Reichman et al., 2014) стали популярными 3D-моделями для исследований сетчатки. Им требуется всего 14–18 дней, чтобы дифференцироваться и самостоятельно собраться в неприсоединившейся культуре. Получаемые в результате структуры гомологичны эмбриональным чашкам сетчатки, наблюдаемым при развитии глаз у позвоночных, и включают фоторецепторы, но не являются идеальными моделями зрелой сетчатки. Они также представляют проблемы, связанные с эпигенетическими эффектами и сфероидальной природой глазных чашек, что препятствует доступу к центру этих органоидов для тестирования или анализа.Попытки вырастить и дифференцировать ЭСК и клетки-предшественники сетчатки в листы сетчатки в пользовательских матрицах были успешными, но показали плохое ламинирование (Worthington et al., 2016; Singh et al., 2018).
, 2012) и ИПСК человека (Meyer et al., 2011; Reichman et al., 2014) стали популярными 3D-моделями для исследований сетчатки. Им требуется всего 14–18 дней, чтобы дифференцироваться и самостоятельно собраться в неприсоединившейся культуре. Получаемые в результате структуры гомологичны эмбриональным чашкам сетчатки, наблюдаемым при развитии глаз у позвоночных, и включают фоторецепторы, но не являются идеальными моделями зрелой сетчатки. Они также представляют проблемы, связанные с эпигенетическими эффектами и сфероидальной природой глазных чашек, что препятствует доступу к центру этих органоидов для тестирования или анализа.Попытки вырастить и дифференцировать ЭСК и клетки-предшественники сетчатки в листы сетчатки в пользовательских матрицах были успешными, но показали плохое ламинирование (Worthington et al., 2016; Singh et al., 2018).
661W представляет собой иммортализованную клеточную линию фоторецепторов колбочек, полученную из опухоли сетчатки мыши, экспрессирующей Т-антиген SV40 (Tan et al. , 2004). Эти клетки в основном использовались в качестве клеточной модели для изучения фотоокислительного стресса и апоптоза, но не для изучения наследственных дистрофий сетчатки.
, 2004). Эти клетки в основном использовались в качестве клеточной модели для изучения фотоокислительного стресса и апоптоза, но не для изучения наследственных дистрофий сетчатки.
Здесь мы характеризуем клеточную линию 661W как модель для изучения цилиопатий сетчатки.
Материалы и методы
Культура клеток
клеток 661W (Tan et al., 2004) были любезным подарком профессора Муайяда Аль-Убайди из Хьюстонского университета. Клетки культивировали в среде DMEM с высоким содержанием глюкозы + 10% FCS при 37 ° C, 5% CO 2 и разделяли в соотношении 1: 5 один раз в неделю. Клетки hTERT-RPE1 (ATCC CRL-4000) культивировали в DMEM / F12 (смесь 50:50) + 10% FCS при 37 ° C, 5% CO 2 и разделяли в соотношении 1: 8 один раз в неделю. .
Иммуноцитохимия
Клетки высевали из расчета 1 × 10 5 на мл на стерильные покровные стекла в полной среде, и через 48 часов среду меняли на среду, не содержащую сыворотки, и клетки выращивали еще 72 часа. Клетки промывали в теплом забуференном фосфатом физиологическом растворе Дульбекко (DPBS) и фиксировали в ледяном метаноле при –20 ° C в течение 5 минут. Затем клетки немедленно промывали PBS и инкубировали с блокирующим раствором (1% мас. / Об. Обезжиренное сухое молоко / PBS) в течение 15 мин при комнатной температуре.Покровные стекла переворачивали на первичные антитела в блокирующем растворе во влажной камере и инкубировали при 4 ° C в течение ночи. После трех промывок PBS клетки инкубировали со вторичными антителами и DAPI в течение 1 ч при комнатной температуре в темноте. После трех промывок PBS и одной промывки dH 2 O клетки помещали на предметные стекла с помощью Mowiol.
Клетки промывали в теплом забуференном фосфатом физиологическом растворе Дульбекко (DPBS) и фиксировали в ледяном метаноле при –20 ° C в течение 5 минут. Затем клетки немедленно промывали PBS и инкубировали с блокирующим раствором (1% мас. / Об. Обезжиренное сухое молоко / PBS) в течение 15 мин при комнатной температуре.Покровные стекла переворачивали на первичные антитела в блокирующем растворе во влажной камере и инкубировали при 4 ° C в течение ночи. После трех промывок PBS клетки инкубировали со вторичными антителами и DAPI в течение 1 ч при комнатной температуре в темноте. После трех промывок PBS и одной промывки dH 2 O клетки помещали на предметные стекла с помощью Mowiol.
Антитела
Первичные антитела к IF
Мышиный анти-полиглутамилированный тубулин (GT335) 1: 1000.
Adipogen Life Sciences AG-20B-0020.
Кролик анти-гамма-тубулин 1: 500. Abcam ab11317.
Кролик против Arl13b 1: 500. Proteintech 17711-1-AP.
Кролик против Ift88 1: 500.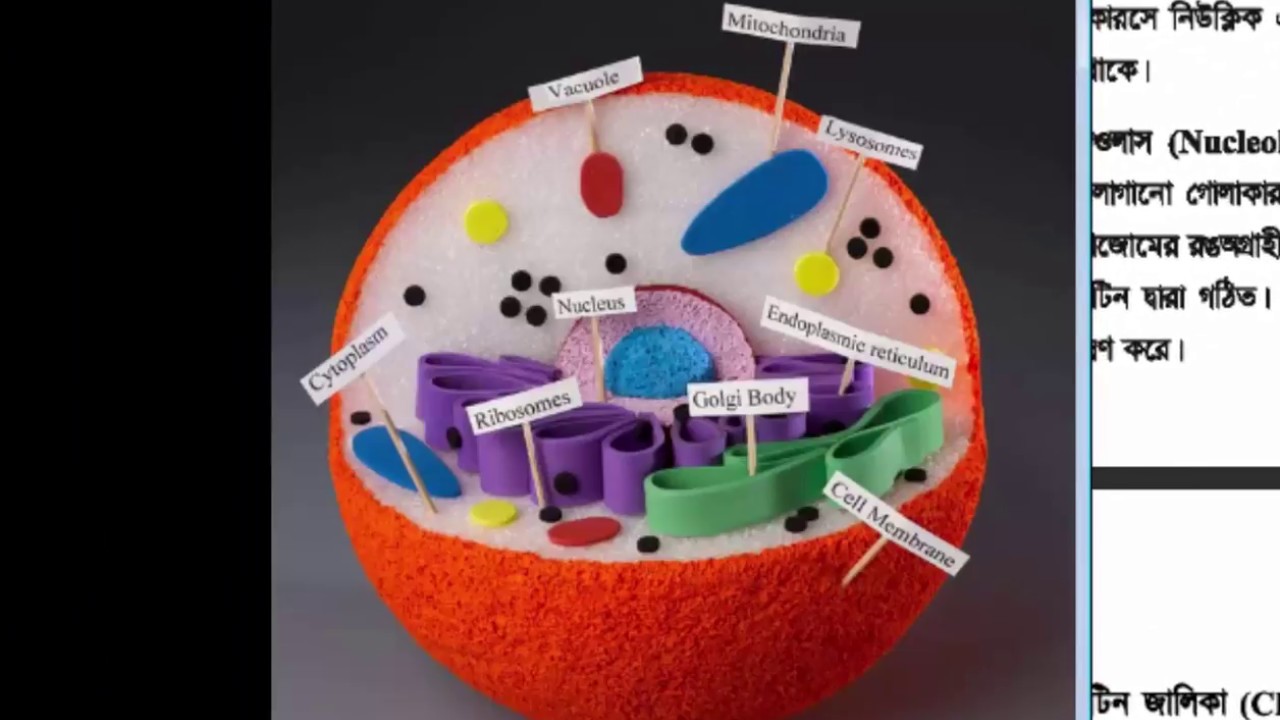 Proteintech 13967-1-AP.
Proteintech 13967-1-AP.
Rabbit anti Rpgrip1l 1: 100. Proteintech 55160-1-AP.
Мышь против Cep164 1: 100. Санта-Крус sc-515403.
Вторичные антитела к IF
Козьи анти-кроличьи IgG AlexaFluor 488 1: 1000.
Козьи антимышиные IgG AlexaFluor 568 1: 1000.
Ослиный антимышиный IgG AlexaFluor 488 1: 500.
Осел против кроличьих IgG AlexaFluor 568 1: 500.
Первичные антитела к WB
Мышиный клон АС-15 против бета-актина. 1: 4000. Сигма-Олдрич A1978.
Кролик против Ift88 1: 500. Proteintech 13967-1-AP.
Вторичные антитела к WB
Donkey anti mouse 680 1: 20 000 (LiCor).
Осел против кролика 800 1: 20,000 (LiCor).
Конфокальная визуализация высокого разрешения
конфокальных изображений было получено в Центре исследований в области биологических наук, учреждении визуализации в UWE Bristol, с использованием HC PL APO 63x / 1.40 масляный объектив CS2 на инвертированном эпифлуоресцентном микроскопе Leica DMi8, присоединенном к конфокальному лазерному сканирующему микроскопу Leica SP8 AOBS с четырьмя твердотельными лазерами с поддержкой AOTF (405 нм / 50 мВт, 488 нм / 20 мВт, 552 нм / 20 мВт и 638 нм / 30 мВт), два стандартных ФЭУ и два высокочувствительных гибридных SMD-GaAsP-детектора HyD. Изображения были получены с использованием программного обеспечения LASX с Hyvolution II, с автоматическими настройками для получения изображений с самым высоким разрешением, с отверстием, установленным на 0,5 AU. Изображения были деконволюционированы с использованием алгоритма оценки максимального правдоподобия Гюйгенса (CMLE) (Scientific Volume Imaging).Изображения были собраны в Adobe Photoshop, а рисунки подготовлены в Adobe Illustrator.
Ручной подсчет и измерение длины ресничек
Клетки, иммуноокрашенные с помощью Arl13b, который маркирует ресничку большей длины, чем наш альтернативный маркер, GT335, были отображены в x63, и три поля зрения были взяты для подсчета числа целых ядер (ядра на краях полей зрения исключены) и числа ресничек. Длину ресничек измеряли с использованием масштабной линейки в качестве ориентира. В эксперименте рассчитывали среднюю длину ресничек и процент ресничных клеток.Это было повторено в пяти независимых биологических повторностях. Средний процент ресничных клеток и среднюю длину ресничек рассчитывали по средним значениям всех экспериментов.
Конфокальная визуализация с высокой пропускной способностью
изображения были получены в Wolfson Bioimaging Facility Бристольского университета с использованием высокопроизводительного формирователя изображения Perkin Elmer OperaLX, с использованием водяного объектива 60x, лазеров с длиной волны 405, 488 и 561 нм. Регулирующая пластина PerkinElmer Opera, содержащая разноцветные шарики, использовалась для определения параметров косой обрезки и эталонных параметров.Клетки выращивали, фиксировали и иммуноокрашивали в 96-луночных планшетах Cell Carrier с оптическим дном (Perkin Elmer), и изображения получали с использованием программного обеспечения OperaDB. Отдельные z-срезы были экспортированы как файлы .flex и собраны в z-стеки проекций максимальной интенсивности в Fiji ImageJ (Schindelin et al., 2012). Эти z-стеки были экспортированы в виде 16-битных файлов TIFF, которые были импортированы в CellProfiler для анализа с использованием настраиваемых протоколов анализа (Carpenter et al., 2006; Kamentsky et al., 2011). В качестве альтернативы, z-стеки были построены в OperaDB, а изображения проанализированы с помощью скриптов PerkinElmer Acapella, включая алгоритмы «Найти ядра», «Найти цитоплазму» и «Найти пятна» (для поиска ресничек).
SDS-PAGE и вестерн-блоттинг
Общий белок экстрагировали из клеток с использованием буфера для лизиса NP40 и соскоба. Нерастворимый материал осаждали центрифугированием при 10000 × g в течение 5 минут и определяли общую концентрацию белка в супернатанте с использованием набора для анализа белков, совместимого с детергентами (BioRad). 20 мкг общего белка на образец смешивали с 2-кратным загрузочным буфером SDS, кипятили при 95 ° C в течение 5 минут и загружали в предварительно отлитые 4–12% гели NuPAGE Novex Bis-Tris (Life Technologies) вместе со Spectra Multicolor Broad Range. Белковая лестница (Thermo Fisher).Образцы разделяли электрофорезом в рабочем буфере MES-SDS (Life Technologies) при 200 В в течение 45 мин. Белок переносили на мембрану из ПВДФ с использованием влажного переноса при 40 В в течение 2 часов. Мембраны инкубировали с 5% (мас. / Об.) Обезжиренным молоком / PBS для насыщения неспецифического связывания и инкубировали с первичным антителом в течение ночи при 4 ° C. После отмывки в PBST мембраны инкубировали со вторичным антителом в течение 1 ч при комнатной температуре и экспонировали с использованием лазера с длиной волны 680 нм и / или 780 нм, или мембрану инкубировали с реагентом SuperSignal West Femto (Pierce) и экспонировали с использованием настроек хемилюминесценции на изображении LiCor Odyssey. система (LiCor).
Сканирующая электронная микроскопия (СЭМ)
Изображения, полученные с помощью сканирующей электронной микроскопии, были получены с использованием полевого эмиссионного электронного микроскопа FEI Quanta FEG 650 в UWE Bristol Center for Research in Biosciences Imaging Facility, используя выдержку 20 мкс, 30,00 кВ HV, 3,45 мкм HFW. Давление 8,33e – 7 Торр, увеличение 60 000 раз.
Секвенирование РНК
Тотальную РНК экстрагировали из ткани с использованием реагента TRI (Sigma-Aldrich). Образцы РНК обрабатывали набором TURBO DNA-free TM Kit (Ambion Inc.) в условиях, рекомендованных производителями, а затем очистили на спин-колонке RNA Clean & Concentrator TM -5 (Zymo Research Corp.). Качество и выход РНК проверяли с помощью спектрофотометра NanoDrop 1000 и биоанализатора Agilent 2100.
Шесть образцов тотальной РНК были предоставлены и подготовлены в библиотеки для секвенирования от ~ 500 нг от Bristol Genomics Facility с использованием набора Illumina TruSeq Stranded mRNA kit. Вкратце, РНК была отобрана по полиА, химически фрагментирована до размера примерно 200 нуклеотидов (время фрагментации 4 мин) и кДНК синтезирована с использованием случайных гексамерных праймеров.Каждая отдельная библиотека получила уникальный штрих-код Illumina.
Качество исходной общей РНК (разведенной 1: 100, чтобы находиться в пределах анализа) и конечных библиотек также оценивали с помощью Agilent TapeStation.
РНК-seq выполняли на приборе Illumina NextSeq500 с шестью мультиплексированными библиотеками и прогоняли по четырем дорожкам на проточную кювету с использованием односторонних считываний 75 п.о. Это привело к более чем 400 миллионам считываний на одну проточную кювету (651Mill, 590Mill PF), в среднем 94 миллиона считываний на образец.
необработанных считываний с четырех дорожек на образец (четыре файла FASTQ) были сопоставлены с полным геномом мыши ( Mus musculus ) (GRCm38, UCSC mm10) с использованием STAR, выравнивателя с поддержкой сплайсинга (Dobin et al., 2013), с Модель гена UCSC mm10.gtf для сплайсинговых соединений и полученные файлы BAM были объединены.
Опять же, используя файл UCSC mm10.gtf, количество сырых генов было оценено в объединенных файлах BAM с использованием HTSeq, с использованием метода объединения и опций –stranded = reverse (Anders et al., 2015). Дифференциальную экспрессию генов анализировали с помощью DESeq2 (Love et al., 2014) со статистической значимостью, выраженной как значение p , скорректированное с учетом коэффициента ложного обнаружения 0,01 с использованием поправки Бенджамини-Хохберга для множественного тестирования.
Генетическая онтология (GO) Анализ обогащения был проведен на генах, которые, как было обнаружено, по-разному экспрессируются между голодными и голодными клетками, с использованием DAVID (Huang da et al., 2009).
Для сравнения с экспрессией клеток hTERT-RPE1 мы загрузили данные о последовательностях РНК из необработанных и лишенных сыворотки клеток hTERT-RPE1 из архива считывания последовательностей (SRA; SRR2895378 и SRR2895380).Эти образцы были отобраны для сравнения с нашими образцами 661 W, потому что те же протоколы использовались для сывороточного голодания, экстракции и очистки РНК, подготовки библиотеки и секвенирования. Однако длина считывания при секвенировании для образцов hTERT-RPE1 была короче, чем для 661 Ws (односторонние считывания 50 пар оснований) и на более низкой глубине (21 миллион считываний и 26 миллионов считываний на образец). Эти данные были ранее опубликованы в Wheway et al. (2015). Необработанные считывания hTERT-RPE1 выравнивали с полным геномом человека ( Homo sapiens ) (GRCh48.92, UCSC hg38) с использованием STAR (Dobin et al., 2013) с генной моделью UCSC hg38.gtf для сплайсинговых соединений.
ИнструментCufflinks (Trapnell et al., 2012) был использован для расчета транскриптов на килобазу экзонов на миллион картированных считываний (TPKM) для всех собранных транскриптов для всех образцов 661W и образцов hTERT-RPE1, а также для сравнений, проведенных между интересующими генами между hTERT -RPE1-клеточная экспрессия и 661W-клеточная экспрессия.
Результаты
Чтобы подтвердить происхождение этой клеточной линии от фоторецепторов колбочек и полностью охарактеризовать профиль экспрессии этих клеток, мы выполнили секвенирование полной транскриптомной РНК на клетках 661W с воздействием сывороточного голодания и без него (номер GEO: GSE119190; номер SRA: SRP159075 ) и сравнили их с экспрессией в клетках hTERT-RPE в тех же условиях роста (SRA, доступ: SRR2895378 и SRR2895380; дополнительная таблица 1).Клеткам не хватало сыворотки в течение 72 часов, чтобы побудить клетки выйти из клеточного цикла и сформировать постмитотические реснички (Santos and Reiter, 2008). Мы отфильтровали данные, чтобы специально изучить 47 генов, которые показывают характерную экспрессию в фоторецепторных клетках колбочек (Sharon et al., 2002; Corbo et al., 2007; рисунок 2A и дополнительная таблица 2). Данные показывают, что клетки 661W экспрессируют ряд маркеров колбочек. Удивительно, но наши данные, по-видимому, предполагают, что OPN1SW экспрессируется в клетках hTERT-RPE1 с TPKM около 4, но анализ в программе Integrative Genomics Viewer (IGV; Robinson et al., 2011), показали, что это было основано на выравнивании многих прочтений с одним экзоном OPN1SW, который является общим с соседним геном CALU, который высоко экспрессируется в этих клетках (Рисунок 2B). Основываясь на нашем анализе других выравниваний в IGV, мы решили исключить любой ген с оценкой численности менее 0,1 TPKM и считать их не экспрессируемыми. На фиг. 2С показаны все маркеры происхождения колбочковых клеток, которые экспрессируются в клетках 661W, но обычно не экспрессируются в клетках hTERT-RPE1, включая альфа-трансдуцин колбочки (Gnat2) и Rom1.Данные свидетельствуют о том, что экспрессия большинства этих генов увеличивается при сывороточном голодании, предполагая, что клетки индуцируются в сторону более конусообразной судьбы при сывороточном голодании (рис. 2С). Коротковолновый и средневолновый опсин (Opn1sw и Opn1mw) и аррестин колбочек (Arr3) не экспрессировались ни в одном из типов клеток. Это контрастирует с ранее опубликованными статьями, показывающими экспрессию этих маркеров колбочек в клеточной линии 661W. В более ранних публикациях изучались ранние пассажи этого типа клеток, тогда как мы изучали клетки между 24 и 27 пассажами.Это говорит о том, что экспрессия этих маркеров колбочек не поддерживается на многих пассажах.
Рисунок 2. Клетки 661W экспрессируют маркеры судьбы фоторецепторов. (A) Тепловая карта экспрессии 48 генов, характерных для фоторецепторов колбочек (Corbo et al., 2007) в клетках hTERT-RPE1 и клетках 661W в условиях сывороточного и сывороточного голодания. Шкала показывает интенсивность цвета относительно TPKM. (B) IGV-снимок экрана местоположения генома OPN1SW в геноме человека hg38, с одним общим экзоном с CALU, который отвечает за сопоставление считываний с OPN1SW в клеточной линии hTERT-RPE1. (C) Тепловая карта, показывающая уровень экспрессии всех генов колбочек, экспрессируемых в клетках 661W, по сравнению с экспрессией этих генов в клетках hTERT-RPE1. Масштабная полоса показывает интенсивность цвета относительно масштабированного значения выражения от –1 до 1 в каждой строке.
Чтобы исследовать экспрессию генов ресничек в этой клеточной линии, мы извлекли данные оценки обилия транскриптов TPKM из наших данных RNAseq для генов Syscilia Gold Standard (SCGS) (van Dam et al., 2013) в голодных и ненасытных клетках hTERT-RPE1 и 661W. .Опять же, исключая любые гены с оценкой численности менее 0,1 TPKM, клетки 661W показали устойчивую экспрессию 213 генов SCGS в не голодных и голодных клетках, включая такие маркеры, как Cep164, Rpgrip1l и Ift88 (дополнительная таблица 3). Клетки также экспрессируют многочисленные гены альфа-бета и гамма-тубулина, а также ферменты, участвующие в посттрансляционной модификации микротрубочек аксонем ресничек, такие как Ttll9, который участвует в полиглутамилировании тубулина. Кроме того, клетки 661W экспрессировали 33 гена, которые либо не экспрессируются в клетках hTERT-RPE1, либо экспрессируются на низком уровне в клетках hTERT-RPE1 (рис. 3A).Сюда входят многие гены заболеваний, связанные с фенотипом цилиопатии сетчатки, включая гены болезни Жубера Ahi1, Arl13b, Pde6b, Tmem138 и Tmem231; Гены болезни Барде-Бидла Arl6, Bbs12, Bbs5, Bbs9, Ift74, Lztfl1 и Trim32; Ген синдрома Сеньора-Локена Iqcb1; гены болезни пигментного ретинита Arl3, Nek2, Rp2 и Topors; Ген врожденного амавроза Лебера Lca5 и; Ген синдрома Ашера Iqcb1 (рис. 3А). В дополнение к этому, клетки 661W экспрессируют несколько генов синдромальной цилиопатии, которые вообще не экспрессируются в клетках hTERT-RPE1, включая B9d1, B9d2, Evc2, Pkd1 и Tmem138 (Рисунок 3B).Для изучения генов этих заболеваний клетки 661W являются ценным ресурсом, поскольку исследования широко используемой клеточной линии сетчатки hTERT-RPE1 не будут эффективными.
Рисунок 3. Клетки 661W экспрессируют маркеры судьбы реснитчатых клеток. (A) Тепловая карта, показывающая уровень экспрессии 33 генов Syscilia Gold Standard (SCGS), экспрессируемых в клетках 661W, которые либо не экспрессируются в клетках hTERT-RPE1, либо экспрессируются на низком уровне в клетках hTERT-RPE1. Зеленые точки указывают на гены болезни синдрома Жубера, синие точки указывают на гены болезни пигментного ретинита, оранжевые точки указывают на гены болезни синдрома Барде-Бидля, точка борвона указывает на ген болезни синдрома Сеньора-Локена, розовая точка указывает на ген врожденного амавроза Лебера, желтая точка указывает на синдром Ашера ген болезни.Стрелки указывают на гены синдромного заболевания, которые экспрессируются в клетках 661W, но совсем не экспрессируются в клетках hTERT-RPE1. (B) График, показывающий среднее значение TPKM выбранных генов SCGS в клетках, не подвергшихся голоданию, и клетках, лишенных сывороточного голодания, чтобы показать активацию этих генов при голодании сыворотки, чтобы вызвать образование ресничек. ∗∗∗ p <0,005; ∗∗ p <0,01; ∗ p <0,05.
Из 213 генов SCGS, экспрессируемых в клетках 661W, имеется статистически значимый ( p <0.05) повышающая или понижающая регуляция 22/213 (10,3%) этих генов при сывороточном голодании. предполагая, что клетки индуцируются к более дифференцированному состоянию после сывороточного голодания (рис. 3B).
Затем мы использовали HTSeq и DESeq2 для идентификации всех генов, по-разному экспрессируемых в разных условиях (голодание или отсутствие голодания), контроля пакетных эффектов и выполнили анализ обогащения для всех совпадений с скорректированным значением p > 0,01 с использованием DAVID ( Huang da et al., 2009; дополнительная таблица 4).Это выявило ряд расширенных кластеров аннотаций, в том числе с терминами GO «дифференциация нейронов» (оценка обогащения 2,22), «развитие глаз» (оценка обогащения 0,16) и «сенсорное восприятие» (оценка обогащения 0,52), «GPCR, родопсин- как суперсемейство »(оценка обогащения 0,25) и« центросома »(оценка обогащения 0,010; дополнительная таблица 4).
Иммуноокрашивание и конфокальная микроскопия этих клеток показывают, что в среднем 30,2% клеток, лишенных сыворотки, вырастают первичные реснички (st.error 2.49, n = 5 независимых повторов), со средней длиной ресничек 3,01 мкм (стандартная ошибка 0,45, n = 5 независимых повторов). Клетки локализуют многие белки ресничек в аксонеме (полиглутамилированный тубулин, Ift88), переходной зоне ресничек (Rpgrip1l), мембране ресничек (Arl13b) и базальном тельце (гамма тубулин; Фигуры 4A – D). Клетки могут вырастать первичные реснички почти до 15 мкм в длину (рис. 4В). Способность образовывать длинные реснички согласуется с длинными аксонемами колбочек, наблюдаемых in vivo .В то время как аксонема фоторецепторов палочек распространяется только вдоль части внешнего сегмента, у Xenopus laevis toads in vivo она проходит вдоль всей наружной части конуса (Eckmiller, 1996). Аксонема большинства первичных ресничек, как правило, сильно посттрансляционно модифицируется, но в клетках 661W полиглутамилирована лишь небольшая часть проксимальной аксонемы (Рисунки 4A – D), что согласуется с аналогичным наблюдением в колбочках у мышей, которые демонстрируют обширное глутамилирование. и гликирование в соединительной области ресничек фоторецептора, но не вдоль аксонемы внешнего сегмента колбочек (Bosch Grau et al., 2017). Этот уровень посттрансляционной модификации строго регулируется в колбочках мышей, а нарушение глицилирования, ведущее к гиперглутамилированию, ведет к дегенерации сетчатки (Bosch Grau et al., 2017). СЭМ показывает, что эти реснички растут в характерных ресничных ямках в клеточной мембране (Рис. 4E).
Рисунок 4. Клетки 661W вырастают длинные первичные реснички. (A) 661W, окрашенные проксимальным аксонемным маркером, полиглутамилированным тубулином (красный), маркер базального тельца γ тубулин (зеленый), показывают, что во многих клетках растут первичные реснички.Клетки контрастировали с DAPI (синий). Масштабная линейка 10 мкм. (B) Окрашивание мембранным маркером ресничек Arl13b (зеленый) показывает, что в этих клетках рост ресничек до прибл. Длина 15 мкм, полиглутамилирована только проксимальная часть аксонемы. Масштабная линейка 10 мкм (C) Окрашивание антителом Ift88 (зеленый) показывает, что этот белок IFT локализуется вдоль реснички, с более концентрированной локализацией в основании и на кончике реснички. Масштабная линейка 10 мкм. (D) Окрашивание антителом Rpgrip1l (зеленый) показывает, что этот переходный белок колокализируется с полиглутамилированным тубулином с более концентрированной локализацией в основании этой области полиглутамилированного тубулина.Масштабная линейка 10 мкм. (E) Изображение клетки 661 W с помощью сканирующего электронного микроскопа, показывающее ресничку в ресничной ямке. Масштабная шкала = 500 нм.
Для дальнейшего определения ультраструктуры этой реснички мы использовали конфокальную микроскопию с деконволюцией для анализа относительной локализации маркера центросомы и базального тела (гамма-тубулин), маркера дистального центриолярного отростка (Cep164), маркера аксонемы (Arl13b) и маркера переходной зоны. (Rpgrip1l) вдоль реснички (Рис. 5A – C). Это выявило мембрану ресничек Arl13b, отходящую от кольца Cep164, лежащую дистальнее кольца гамма-тубулина базального тельца, происходящего от материнской центриоли.Второе кольцо гамма-тубулина дочерней центриоли лежит примерно под прямым углом к этому базальному телу. Rpgrip1l, маркер переходной зоны, простирается изнутри кольца Cep164 за пределы этого кольца, предположительно вдоль аксонемы реснички. Это отличается от описаний локализации Rpgrip1l внутри переходной зоны в первичных ресничках, где обычно видно, что он располагается в плотном кольце, более узком по диаметру до Cep164, но более дистальнее от Cep164 (Yang et al., 2015). Однако известно, что сборка переходной зоны очень специфична для каждого типа клеток, и Rpgrip1l играет ключевую роль в этом процессе (Wiegering et al., 2018). Распространение Rpgrip1l дальше дистальных придатков в этой клеточной линии напоминает локализацию RPGR1P1L в фоторецепторах in vivo , где он локализуется вдоль соединительной реснички (Dharmat et al., 2018).
Рис. 5. Ультраструктура реснички 661 W. (A) Hyvolution визуализация дистального центриолярного маркера придатка Cep164 (красный), который локализуется специфически в зрелой материнской центриоле базального тельца, и белка мембраны ресничек Arl13b (зеленый). (B) Hyvolution визуализация дистального центриолярного маркера придатка Cep164 (красный), который локализуется специфически в зрелой материнской центриоле базального тела, и γ-тубулина (зеленый), который маркирует материнские и дочерние центриоли. Масштабная линейка = 5 мкм. (C) Hyvolution визуализация дистального центриолярного маркера придатка Cep164 (красный) и белка переходной зоны Rpgrip1l (зеленый). Масштабная линейка = 5 мкм. (D) Схематическое изображение локализации белка в ресничках 661W, помечено масштабными полосами.Звездочки символизируют область полиглутамилирования аксонемы.
Данные о некодирующей РНК, полученные при секвенировании РНК этой клеточной линии, идентифицируют ряд новых РНК, ранее не связанных с судьбой фоторецепторов (дополнительная таблица 5). Наиболее примечателен mmu-mir-6236, который экспрессировался на очень высоких уровнях в голодных и не голодных клетках. Эта miRNA ранее не была связана с судьбой или функцией фоторецепторов. Было также обнаружено, что эти клетки экспрессируют miR-17-hg, которая ранее была связана с дифференцировкой нейронов (Bian et al., 2013; Mao et al., 2016) и могут способствовать дифференцировке фоторецепторов нейронов в этих клетках. Интересно, что экспрессия этой микроРНК, как было показано, способствует росту кист при поликистозной болезни почек, распространенной цилиопатии (Patel et al., 2013). Можно предположить, что эта miRNA играет роль в цилиогенезе как в почках, так и в фоторецепторах.
Наконец, чтобы оценить применимость клеток 661 W для высокопроизводительного скрининга, мы выполнили нокдаун siRNA белка ресничек Ift88 в клетках 661 W в 96-луночных культуральных планшетах с оптическим дном и проанализировали количество клеток и количество ресничек с помощью высокой визуализация содержимого с использованием Arl13b и полигутамилированного тубулина в качестве маркеров ресничек (рис. 6А).Ядра идентифицировали с использованием DAPI, а реснички выявляли с использованием модифицированного алгоритма анализа изображений Perkin Elmer «поиск пятен». Это показало, что нокдаун положительного контроля Plk1 индуцировал статистически значимое уменьшение количества клеток (фиг. 6B), а нокдаун Ift88 индуцировал статистически значимое уменьшение количества клеток с одной ресничкой (фиг. 6B, C). Вестерн-блоттинг подтвердил нокдаун Ift88 (фиг. 6D). Автоматический анализ изображений показал хорошее согласие с нашими ручными измерениями количества ресничек; около 22% клеток используют подсчет вручную.
Рис. 6. Высококачественная визуализация ячеек 661 Вт. (A) Примеры изображений из Perkin Elmer Opera, показывающие клетки 661W, окрашенные глутамилированным тубулином (красный), Arl13b (зеленый) и DAPI (синий). (B) Среднее количество целых клеток в поле зрения статистически значимо снижается после 72 ч нокдауна миРНК Plk1 и Ift88 по сравнению с клетками, обработанными нецелевым контролем, ∗∗∗ p <0,0001. (C) % клеток с единственной ресничкой на поле зрения статистически значимо снижается через 72 ч нокдауна миРНК Ift88 по сравнению с клетками, обработанными нецелевым контролем, ∗∗ p <0.001, # — контрольный эксперимент, с которым сравнивается статистическая значимость нокдаунов. (D) Вестерн-блоттинг подтверждает снижение уровня белка Ift88 (зеленый) через 72 часа нокдауна миРНК Ift88 по сравнению с нецелевым контролем. Красный показывает контроль загрузки бета-актина.
Обсуждение
Наше всестороннее глубокое секвенирование общей мРНК и выбранных некодирующих РНК в клеточной линии 661 W подтверждает ее происхождение от фоторецепторов колбочек и способность выращивать фоторецептороподобные реснички в культуре после сывороточного голодания (рисунки 2–4 и дополнительная таблица 1) .В недавней статье клеточная линия 661 W описана как линия клеток сетчатки, подобная ганглию, благодаря экспрессии в ней маркеров, специфичных для ганглиозных клеток сетчатки, таких как Rbpms, Pouf2, Pouf3, Thy1 и γ-синуклеин (Sayyad et al., 2017). Наши данные о последовательности РНК полного транскриптома подтверждают, что эта клеточная линия экспрессирует Rbpms, Thy1 и Sncg на низких уровнях, но не экспрессирует Pouf2 или Pouf3 (дополнительная таблица 1). Это говорит о том, что эта клеточная линия действительно имеет некоторые особенности ганглиозных клеток сетчатки, но также экспрессирует маркеры судьбы фоторецепторов колбочек.Наши данные подтверждают вывод Sayyad et al. (2017), что эта клеточная линия демонстрирует свойства как ганглия сетчатки, так и фоторецепторных клеток, и является полезной моделью фоторецептора in vitro .
Иммунофлуоресцентная конфокальная микроскопия и деконволюция изображений этих клеток выявляют реснички, сходные по структуре с ресничками колбочки фоторецепторов in vivo . После сывороточного голодания в культуре около трети клеток расширяют реснички длиной около трех микрон, которые посттрансляционно модифицируются только на проксимальном конце и локализуют Rpgrip1l вдоль этой проксимальной области (Рис. 4, 5).Клеточная линия экспрессирует множество генов ресничек bona fide , в том числе многие мутировавшие при цилиопатиях сетчатки, и экспрессия многих из них увеличивается при сывороточном голодании клеток (фиг. 3 и дополнительная таблица 3). Нокдаун ключевого гена ресничек Ift88 приводит к стойкому снижению процента целых клеток с единственной ресничкой, что может быть легко проанализировано с помощью визуализации с высоким содержанием (Рис. 6).
Наша демонстрация визуализации высокого содержания клеток 661 W иллюстрирует потенциальную полезность этой линии клеток для высокопроизводительного скрининга.Недавний высокопроизводительный скрининг малых молекул в клетках hTERT-RPE1 успешно идентифицировал эупатилин как небольшую молекулу, которая устраняет дефекты переходной зоны в клетках RPE1, нокаутирующих CEP290 (Kim et al., 2018). Подобный подход с использованием клеток 661 W может быть еще более клинически значимым методом для идентификации небольших молекул, которые могут быть использованы для лечения цилиопатий сетчатки. Точно так же клеточная линия может быть полезна для обратного генетического функционального скрининга геномики для выявления новых генов ресничек сетчатки и генов-кандидатов на цилиопатию сетчатки, аналогично предыдущим скринингам (Wheway et al., 2015). Эти методы имеют огромное значение в области, где так мало эффективных методов лечения.
Клеточная линия 661 W может быть особенно полезной для изучения генов цилиопатии, которые не экспрессируются в клетках hTERT-RPE1 или экспрессируются только на низком уровне в этой клеточной линии (рис. 3А).
Таким образом, мы предоставляем доказательства того, что клетки 661 W являются полезной моделью in vitro для изучения цилиопатий сетчатки.
Авторские взносы
GW задумал исследование, провел эксперименты, провел анализ данных, визуализацию, анализ изображений, биоинформатический анализ и написал статью.LN проводила эксперименты, проводила анализ данных, визуализацию и анализ изображений. DT внесла свой вклад в биоинформатический анализ. Компания SC предоставила поддержку в области высокопроизводительной визуализации и анализа изображений.
Финансирование
LN и GW поддерживаются небольшой премией SAC019 Национального совета по исследованиям зрения, премией Wellcome Trust Seed Award в области науки (грант № 204378 / Z / 16 / Z) и фондами исследований качества UWE Bristol. SC был поддержан Институтом Элизабет Блэквелл через награду Wellcome Trust ISSF.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы хотели бы поблагодарить доктора Дэвида Паттона за помощь с SEM. Мы хотели бы поблагодарить профессора Муайяда Аль-Убайди за дар клеток 661 W и профессора Джереми Натанса за дар антител к опсину. Мы хотели бы поблагодарить всех сотрудников Scientific Volume Imaging за помощь в деконволюции Гюйгенса.GW благодарит профессора Дэвида Стивенса и профессора Кэтрин Нобс за предоставление доступа к лабораториям Школы биохимии Бристольского университета.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fgene.2019.00308/full#supplementary-material
ТАБЛИЦА S1 | Оценка обилия транскриптов в транскриптах на килобазу экзона на миллион картированных считываний (TPKM) для всех генов во всех повторах голодных и не голодных клеток 661W (вкладка 1) и клеток hTERT-RPE1 (вкладка 2).
ТАБЛИЦА S2 | Оценка обилия транскриптов в транскриптах на килобазу экзона на миллион картированных считываний (TPKM) для 47 генов колбочек фоторецепторов во всех повторах голодных и не голодных клеток 661W и клеток hTERT-RPE1.
ТАБЛИЦА S3 | Оценка обилия транскриптов в транскриптах на килобазу экзона на миллион картированных считываний (TPKM) для 277 генов Syscilia Gold Standard (SCGS) во всех повторах голодных и не голодных клеток 661W и клеток hTERT-RPE1.
ТАБЛИЦА S4 | Результаты анализа дифференциальной экспрессии генов голодных и не голодных клеток 661W (вкладка 1) и кластерного анализа функциональной аннотации DAVID дифференциально экспрессируемых генов (вкладка 2).
ТАБЛИЦА S5 | Оценка обилия транскриптов в транскриптах на килобазу экзона на миллион картированных считываний (TPKM) для некодирующих РНК во всех повторах голодных и не голодных клеток 661W.
Сноски
- https://sph.uth.edu/retnet/sum-dis.htm
Список литературы
Альстром, К. Х. (1957). Врожденная ретинопатия — monohybrida recessiva autosomalis. Hereditas 43, 1–77.
Google Scholar
Андерс, С., Пил П. Т., и Хубер В. (2015). HTSeq — среда Python для работы с высокопроизводительными данными секвенирования. Биоинформатика 31, 166–169. DOI: 10.1093 / биоинформатика / btu638
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bian, S., Hong, J., Li, Q., Schebelle, L., Pollock, A., Knauss, J. L., et al. (2013). Кластер микроРНК miR-17-92 регулирует экспансию нервных стволовых клеток и переход к промежуточным предшественникам в развивающейся неокортексе мыши. Cell Rep. 3, 1398–1406. DOI: 10.1016 / j.celrep.2013.03.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bosch Grau, M., Masson, C., Gadadhar, S., Rocha, C., Tort, O., Marques Sousa, P., et al. (2017). Нарушение баланса глицилирования тубулина и глутамилирования в фоторецепторах приводит к дегенерации сетчатки. J. Cell Sci. 130, 938–949. DOI: 10.1242 / jcs.199091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карпентер, А.Э., Джонс, Т. Р., Лампрехт, М. Р., Кларк, К., Канг, И. Х., Фриман, О. и др. (2006). CellProfiler: программное обеспечение для анализа изображений для определения и количественной оценки фенотипов клеток. Genome Biol. 7: R100. DOI: 10.1186 / GB-2006-7-10-r100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коллин, Г. Б., Маршалл, Дж. Д., Кинг, Б. Л., Милан, Г., Маффеи, П., Джаггер, Д. Дж. И др. (2012). Белок синдрома Альстрома, ALMS1, взаимодействует с альфа-актинином и компонентами пути рециклинга эндосом. PLoS One 7: e37925. DOI: 10.1371 / journal.pone.0037925
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корбо, Дж. К., Майерс, К. А., Лоуренс, К. А., Джадхав, А. П., и Чепко, К. Л. (2007). Типология паттернов экспрессии гена фоторецепторов у мышей. Proc. Natl. Акад. Sci. США 104, 12069–12074. DOI: 10.1073 / pnas.0705465104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ден Холландер, А. И., Коенекоп, Р.К., Мохамед, М. Д., Артс, Х. Х., Болдт, К., Таунс, К. В. и др. (2007). Мутации в LCA5, кодирующем цилиарный белок леберсилин, вызывают врожденный амавроз Лебера. Nat. Genet. 39, 889–895. DOI: 10,1038 / нг2066
PubMed Аннотация | CrossRef Полный текст | Google Scholar
den Hollander, A. I., Koenekoop, R. K., Yzer, S., Lopez, I., Arends, M. L., Voesenek, K. E. J., et al. (2006). Мутации в гене CEP290 (NPHP6) — частая причина врожденного амавроза Лебера. Am. J. Hum. Genet. 79, 556–561. DOI: 10.1086 / 507318
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дхармат Р., Эблимит А., Робишо М. А., Чжан З., Нгуен Т. Т., Юнг С. Ю. и др. (2018). SPATA7 поддерживает новую зону, специфичную для фоторецепторов, в дистальной соединительной ресничке. J. Cell Biol. 217: 2851. DOI: 10.1083 / jcb.201712117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Добин, А., Дэвис, К.A., Schlesinger, F., Drenkow, J., Zaleski, C., Jha, S., et al. (2013). STAR: сверхбыстрый универсальный выравниватель RNA-seq. Биоинформатика 29, 15–21. DOI: 10.1093 / биоинформатика
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Драйджа, Т. П., Адамс, С. М., Гримсби, Дж. Л., МакГи, Т. Л., Хонг, Д., Ли, Т. и др. (2001). Нулевые аллели RPGRIP1 у пациентов с врожденным амаврозом Лебера. Am. J. Hum. Genet. 68, 1295–1298. DOI: 10.1086 / 320113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Данн, К.К., Аотаки-Кин, А. Е., Путки, Ф. Р., и Хьелмеланд, Л. М. (1996). ARPE-19, линия пигментных эпителиальных клеток сетчатки человека с дифференцированными свойствами. Exp. Eye Res. 62, 155–169. DOI: 10.1006 / exer.1996.0020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Экмиллер, М. С. (1996). Обновление аксонемы ресничек в конусных внешних сегментах сетчатки Xenopus laevis . Cell Tissue Res. 285, 165–169. DOI: 10.1007 / s004410050632
CrossRef Полный текст | Google Scholar
Эйраку, М., Таката, Н., Исибаши, Х., Кавада, М., Сакакура, Э., Окуда, С. и др. (2011). Самоорганизующийся морфогенез глазного бокала в трехмерной культуре. Природа 472, 51–56. DOI: 10.1038 / nature09941
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эстрада-Кускано, А., Коенекоп, Р., и Коль, К. Ф. (2010). Мутации IQCB1 у пациентов с врожденным амаврозом Лебера. Инвест. Офтальмол. Vis. Sci. 52, 834–839. DOI: 10.1167 / iovs.10-5221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Головлева, И., Кон, Л., Бурстедт, М., Дайгер, С., и Сандгрен, О. (2010). Спектры мутаций при аутосомно-доминантном и рецессивном пигментном ретините в северной Швеции. Adv. Exp. Med. Биол. 664, 255–262. DOI: 10.1007 / 978-1-4419-1399-9_29
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hamel, C.P., Griffoin, J.M., Bazalgette, C., Lasquellec, L., Duval, P.A., Bareil, C., et al. (2000). Молекулярная генетика пигментных ретинопатий: выявление мутаций в генах CHM, RDS, RHO, RPE65, USh3A и XLRS1. J. Fr. Офтальмол. 23, 985–995.
PubMed Аннотация | Google Scholar
Хирн Т., Ренфорт Г. Л., Спаллуто К., Хэнли Н. А., Пайпер К., Бриквуд С. и др. (2002). Мутация ALMS1, большого гена с тандемным повтором, кодирующим 47 аминокислот, вызывает синдром альстрома. Nat. Genet. 31, 79–83. DOI: 10.1038 / ng874
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Heher, K. L., Traboulsi, E. I., and Maumenee, I.H.(1992). Естественное течение врожденного амавроза Леберса — возрастные данные у 35 пациентов. Офтальмология 99, 241–245. DOI: 10.1016 / S0161-6420 (92) 31985-2
CrossRef Полный текст | Google Scholar
Хуан да, В., Шерман, Б. Т., и Лемпицки, Р. А. (2009). Систематический и комплексный анализ больших списков генов с использованием ресурсов биоинформатики DAVID. Nat. Protoc. 4, 44–57. DOI: 10.1038 / nprot.2008.211
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каменцкий, Л., Джонс, Т. Р., Фрейзер, А., Брей, М. А., Логан, Д. Дж., Мэдден, К. Л. и др. (2011). Улучшенная структура, функции и совместимость с Cell Profiler: модульное высокопроизводительное программное обеспечение для анализа изображений. Биоинформатика 27, 1179–1180. DOI: 10.1093 / биоинформатика / btr095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, Ю. Дж., Ким, С., Юнг, Ю., Юнг, Э., Квон, Х. Дж., И Ким, Дж. (2018). Эупатилин устраняет дефекты переходной зоны ресничек, улучшая фенотипы, связанные с цилиопатией. J. Clin. Вкладывать деньги. 128, 3642–3648. DOI: 10.1172 / JCI99232
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли К., Уоллингфорд Дж. Б. и Гросс Дж. М. (2014). Cluap1 важен для цилиогенеза и поддержания фоторецепторов в глазах позвоночных. Инвест. Офтальмол. Vis. Sci. 55, 4585–4592. DOI: 10.1167 / iovs.14-14888
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mansergh, F. C., Vawda, R., Millington-Ward, S., Kenna, P. F., Haas, J., Gallagher, C., et al. (2010). Потеря фоторецепторного потенциала из культур клеток-предшественников сетчатки, несмотря на улучшение выживаемости. Exp. Eye Res. 91, 500–512. DOI: 10.1016 / j.exer.2010.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мао, С., Ли, X., Ван, Дж., Дин, X., Чжан, К., и Ли, Л. (2016). miR-17-92 облегчает нейрональную дифференцировку трансплантированных нервных стволовых клеток / клеток-предшественников при нейровоспалительных условиях. J. Нейровоспаление 13: 208. DOI: 10.1186 / s12974-016-0685-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Меллоу, К. Б., Сернагор, Э., Морено-Гимено, И., Стил, Д. Х., Лако, М. (2012). Эффективная стадия дифференцировки плюрипотентных стволовых клеток человека в фоторецепторные клетки сетчатки. Стволовые клетки 30, 673–686. DOI: 10.1002 / стержень.1037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мейер, Дж.С., Хоуден, С. Е., Уоллес, К. А., Верховен, А. Д., Райт, Л. С., Чаповски, Е. Е. и др. (2011). Структуры, подобные оптическим везикулам, полученные из плюрипотентных стволовых клеток человека, облегчают индивидуальный подход к лечению заболеваний сетчатки. Стволовые клетки 29, 1206–1218. DOI: 10.1002 / стержень.674
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накано, Т., Андо, С., Таката, Н., Кавада, М., Мугурума, К., Секигучи, К. и др. (2012). Самоформирование глазных бокалов и хранимой стратифицированной нервной сетчатки из человеческих ESCs. Стволовые клетки клеток 10, 771–785. DOI: 10.1016 / j.stem.2012.05.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пател В., Уильямс Д., Хаджарнис С., Хантер Р., Понтоглио М., Сомло С. и др. (2013). miR-17∼92 кластер miRNA способствует росту кист почек при поликистозной болезни почек. Proc. Natl. Акад. Sci. США 110, 10765–10770. DOI: 10.1073 / pnas.1301693110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пирринг, Дж.Н., Салинас, Р. Ю., Бейкер, С. А., Аршавский, В. Ю. (2013). Сортировка, нацеливание и перемещение белков в фоторецепторных клетках. Prog. Retin. Eye Res. 36, 24–51. DOI: 10.1016 / j.preteyeres.2013.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райхман, С., Террей, А., Слембрук, А., Нанто, К., Орие, Г., Хабелер, В., и др. (2014). От сливающихся iPS-клеток человека до самоформирующихся нервных клеток сетчатки и пигментированного эпителия сетчатки. Proc.Natl. Акад. Sci. США 111, 8518–8523. DOI: 10.1073 / pnas.1324212111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Робинсон, Дж. Т., Торвальдсдоттир, Х., Винклер, В., Гутман, М., Ландер, Э. С., Гетц, Г. и др. (2011). Программа просмотра интегративной геномики. Nat. Biotechnol. 29:24. DOI: 10.1038 / NBT.1754
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ронкильо, К. К., Ханке-Гогохиа, К., Ревело, М. П., Фредерик, Дж.М., Цзян, Л. и Баэр, В. (2016). Связанный с цилиопатией белок IQCB1 / NPHP5 необходим для образования внешнего сегмента фоторецептора мыши. FASEB J. 30, 3400–3412. DOI: 10.1096 / fj.201600511R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Руф, Д., Адамян, М., Джейкобс, Д., и Хейс, А. (1991). Специализация цитоскелета на дистальном конце фоторецептора стержня. J. Comp. Neurol. 305, 289–303. DOI: 10.1002 / cne.0210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сайяд, З., Сирохи, К., Радха, В., Сваруп, Г. (2017). 661W представляет собой клеточную линию, подобную предшественнику ганглия сетчатки, в которой ассоциированные с глаукомой мутанты оптинейрина избирательно индуцируют гибель клеток. Sci. Отчет 7: 16855. DOI: 10.1038 / s41598-017-17241-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schappert-kimmijser, J., Henkes, H.E., and Van den Bosch, J. (1959). Врожденный амавроз (Лебер). Arch. Офтальмол. 1959, 211–218. DOI: 10.1001 / archopht.1959.009400
003
CrossRef Полный текст | Google Scholar
Schindelin, J., Arganda-Carreras, I., Frize, E., Kaynig, V., Longair, M., Pietzsch, T., et al. (2012). Фиджи: платформа с открытым исходным кодом для анализа биологических изображений. Nat. Методы 9, 676–682. DOI: 10.1038 / nmeth.2019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сингх Д., Ван, С. Б., Ся, Т., Тайнш, Л., Гиасси-Нежад, М., Сюй, Т. и др. (2018). Биоразлагаемый каркас усиливает дифференциацию эмбриональных стволовых клеток в толстый слой клеток сетчатки. Биоматериалы 154, 158–168. DOI: S0142-9612 (17) 30717-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарон, Д., Банин, Э. (2015). Несиндромный пигментный ретинит широко распространен в районе Иерусалима с высокой частотой мутаций-основателей. Мол. Vis. 21, 783–792.
PubMed Аннотация | Google Scholar
Шарон, Д., Блэкшоу, С., Чепко, К. Л., и Дриджа, Т. П. (2002). Профиль генов, экспрессируемых в периферической сетчатке, желтом пятне и пигментном эпителии сетчатки человека, определяется посредством серийного анализа экспрессии генов (SAGE). Proc. Natl. Акад. Sci. США 99, 315–320. DOI: 10.1073 / pnas.012582799
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шёстранд, Ф. С. (1953). Ультраструктура наружных сегментов палочек и колбочек глаза, обнаруженная с помощью электронного микроскопа. J. Cell Comp. Physiol. 42, 15–44. DOI: 10.1002 / jcp.1030420103
CrossRef Полный текст | Google Scholar
Соенс, З. Т., Ли, Ю., Чжао, Л., Эблимит, А., Дхармат, Р., Li, Y., et al. (2016). Гипоморфные мутации выявлены в кандидате гена врожденного амавроза Лебера CLUAP1. Genet. Med. 18, 1044–1051. DOI: 10.1038 / gim.2015.205
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Спаллуто, К., Уилсон, Д. И., Хирн, Т. (2013). Доказательства рецилиляции клеток RPE1 в поздней фазе G1 и цилиарной локализации циклина B1. FEBS Open Bio 3, 334–340. DOI: 10.1016 / j.fob.2013.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стоун, Э.М. (2007). Врожденный амавроз Лебера — модель для эффективного генетического тестирования гетерогенных заболеваний: LXIV Мемориальная лекция Эдварда Джексона. Am. J. Ophthalmol. 144, 791–811. DOI: 10.1016 / j.ajo.2007.08.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тан, Э., Дин, X.Q., Саади, А., Агарвал, Н., Нааш, М. И., и Аль-Убайди, М. Р. (2004). Экспрессия антигенов колбочек-фоторецепторов в клеточной линии, полученной из опухолей сетчатки у трансгенных мышей. Инвест. Офтальмол. Vis. Sci. 45, 764–768.
 У вас могло
создаться неправильное впечатление, что клетки
плоские. На самом деле они имеют объем. Давайте
убедимся в этом, сделав своими руками модель
какой-либо клетки.
У вас могло
создаться неправильное впечатление, что клетки
плоские. На самом деле они имеют объем. Давайте
убедимся в этом, сделав своими руками модель
какой-либо клетки.
